La Farmacologia studia i farmaci e le interazioni che hanno luogo tra questi e gli organismi viventi. Per farmaco si intende ogni sostanza capace di provocare in un organismo modificazioni funzionali mediante un’azione chimica o fisica su un bersaglio molecolare che ne viene modificato in modo che ne sortisca un effetto biologico.
Queste modificazioni possono essere sfruttate in modo positivo e portare a risultati utili in terapia o possono, invece, produrre effetti negativi o tossici. Da queste sintetiche definizioni si può subito comprendere quanto sia vasto il campo di studio della Farmacologia e come il farmacologo debba possedere conoscenze sui composti attivi (la struttura chimica e le loro caratteristiche biofisiche, le metodiche di sintesi e, nel caso di prodotti di estrazione, la loro provenienza), sull’organismo con il quale interagiscono e sulle patologie che lo affliggono. Come diceva Leonardo da Vinci: «il medico adoprerà bene le medicine quando lui conoscerà che cosa è omo, che cosa è vita e complessione, che cosa è sanità».
In questo senso la Farmacologia è vicinissima alla Fisiologia, in quanto si occupa dei mezzi chimici che modificano le funzioni fisiologiche, è legata alla patologia in quanto capace di interpretare le cause chimiche che stanno alla base delle variazioni patologiche, è molto affine alla Chimica biologica e alla Biologia cellulare e molecolare in quanto utilizza le metodiche di queste discipline e mette a disposizione strumenti (farmaci e molecole) capaci di influire sui diversi processi biologici che caratterizzano la vita della cellula. Essa è infine ponte tra la ricerca di base e la clinica in quanto fornisce i più importanti strumenti terapeutici e, spesso, attraverso di essi, anche una chiave diagnostica e interpretativa delle patologie più complesse.
L’uso dei farmaci ha sostanzialmente cambiato la vita dell’uomo. I progressi nel settore della salute che si sono avuti in questo secolo nei paesi sviluppati sono sicuramente legati all’aumentato benessere economico che ha portato al miglioramento delle condizioni igieniche, a una più diffusa cultura della prevenzione e della salute, a un’alimentazione più ricca e più armonica, a una vita lavorativa meno pesante, ma certamente gli effetti non sarebbero stati così eclatanti sulla qualità e quantità di vita senza l’aiuto dei farmaci.
I farmaci hanno contribuito non solo alla scomparsa di molte gravi malattie (basti pensare che nell’Ospedale Maggiore di Milano prima della seconda guerra mondiale le morti da polmonite batterica si contavano nell’ordine delle decine al giorno nei mesi invernali), ma anche a una ridotta ospedalizzazione, a minori danni permanenti da malattie, al controllo di molte patologie gravi e degenerative.
Alcuni esempi di questi successi sono: la terapia della Malattia di Parkinson attraverso l’uso della levo-DOPA e dei farmaci da essa derivati, che ha restituito anni di vita e qualità di vita a malati gravi e fortemente dipendenti dall’aiuto esterno, (si veda per una vivace e veritiera documentazione di questa scoperta il film Risvegli tratto dall’omonimo libro di Oliver Sacks); il ruolo recente ed eclatante dei farmaci sul controllo di patologie gravi come l’AIDS che, grazie alla messa a punto di farmaci antivirali con diverso meccanismo d’azione, ha cambiato completamente faccia, trasformata nel giro di pochi anni da «peste del secolo» a malattia cronica compatibile con una vita quasi normale per lunghi anni; e infine il recentissimo successo terapeutico che ha permesso di curare, nel 90% dei casi e con un trattamento breve, la Epatite da virus C, una piaga che colpisce più di 130-170 milioni di individui al mondo e che a causa di questa infezione erano posti su una strada altamente ricca di sofferenze quali la cirrosi epatica, l’insufficienza epatica, il cancro del fegato. Questi tre esempi mostrano chiaramente la potenza di alcune terapie farmacologiche, ma anche i grandi problemi economici che esse pongono, per esempio la terapia della epatite C in tutti i pazienti affetti .
La Farmacologia ha inoltre contribuito a modificare molti costumi sia a livello di individuo che di società: si pensi per esempio al controllo della fertilità e alla dissociazione tra l’atto sessuale e la procreazione, al controllo o allo stimolo delle emozioni, al potenziamento (più o meno lecito) di alcune prestazioni sia fisiche sia mentali, alla diffusione delle patologie da farmaci, il cui esempio più eclatante e negativo è la tossicodipendenza.
Il successo dei farmaci è stato così imponente da far illudere molti che ci possa essere una «pillola» per ogni male. Nascono così anomalie come l’eccessiva medicalizzazione, la scarsa accettazione del fatto che possano ancora esistere malattie non curabili e un’aspettativa eccessiva sui «miracolosi progressi della medicina» che, quando si scontra con la realtà dell’insuccesso, può portare nel pubblico a un senso di sfiducia generalizzato, a irrazionale rifiuto della terapia medica sperimentata e alla fuga verso l’ignoto delle così dette «medicine alternative».
La Farmacologia ha creato regole severe di sperimentazione preclinica e clinica dei farmaci che permettono di definire regole per la messa a punto, la scelta e l’uso razionale dei farmaci stessi e di conoscerne al meglio l’efficacia terapeutica e la tossicità.
Queste regole severe non escludono che si possano ancora avere fenomeni di tossicità legata al farmaco, ma hanno limitato quasi completamente quei casi di tossicità grave e inaspettata come quello della focomelia da talidomide.
Queste regole, la cui applicazione ha un elevato costo economico, sono spesso ignorate in altre forme di medicina. Le pesanti conseguenze di questa ignoranza è che questi approcci «alternativi» non possono garantire una dimostrata e ragionevole probabilità di successo pur comportando rischi per la tossicità e la dilazione di terapie efficaci.
Le ricadute di tipo economico, e soprattutto etico che tutto questo comporta, fanno della Farmacologia una disciplina scientifica in cui agli aspetti tecnici si associano altrettanto importanti aspetti etici. A chi si addentra, quindi, nello studio della Farmacologia si apre un ventaglio di conoscenze multidisciplinari che rendono più vario e interessante il suo cammino culturale attraverso esperimenti complessi e difficili.
Cosa si intende per farmaco
Nell’accettazione più ampia, il termine farmaco identifica qualunque sostanza in grado di esercitare un effetto sui sistemi viventi. In tal senso, i farmaci trovano impiego sia in quanto strumenti terapeutici in grado di intervenire su processi patologici sia come strumenti sperimentali per la comprensione di eventi biologici.
Dal punto di vista storico il termine utilizzato per indicare il farmaco ha subito numerose modificazioni sia concettuali sia lessicali. Passiamo dal termine semplici utilizzato nel Medio Evo per indicare le erbe medicinali (coltivate nell’horto dei semplici) nonché sostanze minerali e di origine animale alle quali si attribuivano capacità terapeutiche, al termine droghe utilizzato nel settecento, al termine sostanza chimica con cui dal novecento in poi si indicano i prodotti di estrazione e/o di sintesi.
Oggi, nel termine farmaco si includono anche i prodotti biologici (per esempio anticorpi) e le cellule stesse, utilizzate come tali o modificate mediante tecniche di ingegneria genetica per produrre farmaci/ormoni in loco oppure per rigenerare o riparare tessuti danneggiati (medicina rigenerativa).
Farmaci generici ed equivalenti.
Quando il brevetto per un farmaco (la sostanza o sua applicazione clinica) decade (in genere dopo 15-20 anni), esso può essere prodotto e venduto liberamente da chiunque, previa autorizzazione da parte delle autorità competenti. Il requisito fondamentale richiesto, oltre alle caratteristiche farmaceutiche di purezza e stabilità, è che il profilo farmacocinetico della nuova formulazione sia sovrapponibile (+/-20%) a quello del prodotto di riferimento.
Il vantaggio per chi acquista il farmaco è che il prezzo è inferiore (circa il 30%) non essendo incluse da parte del produttore le spese per la ricerca e lo sviluppo, mentre non vi sono differenze sostanziali tra il farmaco di riferimento e la sua copia.
Una certa attenzione va esercitata per quei farmaci nei quali la differenza tra dose terapeutica e dose che produce effetti non voluti sia molto bassa e nel raro caso di reazioni allergiche ai componenti utilizzati per completare la formulazione commerciale del farmaco. Nel caso di farmaci biologici (peptidi e anticorpi monoclonali), dato che è quasi impossibile riprodurre esattamente la struttura chimica del farmaco-copia rispetto a quello di riferimento, le agenzie che regolano e controllano l’immissione in commercio dei farmaci esigono oltre a una cinetica appropriata anche la dimostrazione di efficacia clinica.
Placebo
Con questo termine si intende una sostanza inerte e priva di effetti biologici rilevanti sull’organismo, confezionata con una preparazione farmaceutica uguale a quella di un farmaco.
Viene utilizzata per compiacere un paziente e ottenere così una risposta terapeutica non in base a un’azione farmacologica, ma in base a un effetto psicologico. È spesso utilizzato in studi clinici controllati per differenziare all’interno dell’azione terapeutica quanto dovuto all’effetto farmacologico vero e proprio e quanto dovuto a effetti scatenati da fenomeni psicologici indotti dal contesto nel quale il farmaco viene somministrato.
Il maggior promotore dell’effetto placebo è in genere il medico o l’ambiente sanitario nel quale il placebo viene somministrato. Per effetto psicologico si intende una serie di modificazioni biochimiche e funzionali scatenate dal placebo che mimano l’effetto diretto dei farmaci in questione. Se prendiamo per esempio un trattamento con farmaci antidolorifici, vediamo che il placebo farà rilasciare nell’organismo sostanze e ormoni analgesici attivando vie analgesiche fisiologiche molto simili a quelle che vengono attivate dai farmaci analgesici.
L’effetto placebo può essere responsabile fino al 30% dell’effetto terapeutico di alcuni farmaci. Il medico avveduto saprà utilizzare il placebo per forme minori di patologie senza utilizzare farmaci che sempre hanno un lato negativo. Si può avere anche un effetto negativo di questo processo e in questo caso la sostanza è chiamata nocebo.
Breve storia della Farmacologia
Come tutte le terre di confine la Farmacologia non conosce confini e trae vantaggio dai progressi che la ricerca compie in campi disparati legandoli al fine ultimo dell’utilizzo dei farmaci a scopo terapeutico o per meglio comprendere il funzionamento degli organismi biologici.
L’immagine che segue mostra in modo esemplificativo il percorso di un farmaco dalla sua ipotesi di partenza, alla sintesi del farmaco, alle verifiche precliniche in vitro e in vivo per la verifica dell’ipotesi di partenza, della sua efficacia in modelli sperimentali e della sua tossicità su organismi viventi.
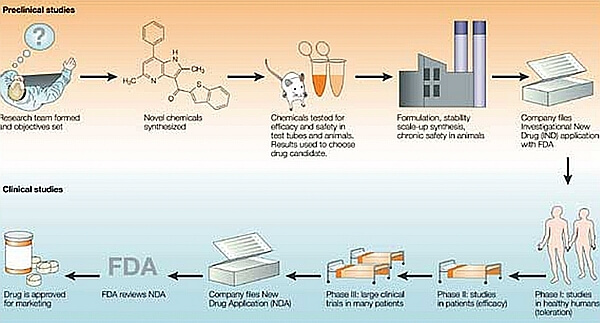 Interazione tra Chimica, Chimica farmaceutica, industria del farmaco, Scienze biologiche di base, Patologia e Clinica e organizzazioni sociali nella realizzazione di un farmaco. Il processo illustrato è schematizzato come un processo lineare, mentre in realtà la domanda di farmaco parte dal letto del malato, si rivolge al farmacologo, al chimico, all’industria con un continuo rimando tra i vari approcci per un continuo raffinamento delle molecole interessanti fino ad arrivare al farmaco più aderente ed efficace a rispondere alla domanda iniziale.
Interazione tra Chimica, Chimica farmaceutica, industria del farmaco, Scienze biologiche di base, Patologia e Clinica e organizzazioni sociali nella realizzazione di un farmaco. Il processo illustrato è schematizzato come un processo lineare, mentre in realtà la domanda di farmaco parte dal letto del malato, si rivolge al farmacologo, al chimico, all’industria con un continuo rimando tra i vari approcci per un continuo raffinamento delle molecole interessanti fino ad arrivare al farmaco più aderente ed efficace a rispondere alla domanda iniziale.
Dopo queste fasi preliminari e essenziali si passa eventualmente al raffinamento del processo di sintesi e produzione e finalmente alla sperimentazione clinica sull’uomo attraverso le quattro fasi ormai ben codificate e validate. Lo schema rappresenta questo processo come un qualche cosa di lineare e unidirezionale mentre nella realtà lo sviluppo è assai più complesso con una serie di rimandi reciproci tra ogni tappa per raffinare al meglio le proprietà del farmaco, aumentarne l’efficacia e ridurne la tossicità.
Le autorità nazionali o internazionali preposte all’immissione in commercio dei farmaci intervengono nel processo decisionale su due punti regolatorii; il primo dopo la conclusione della fase preclinica per valutare se l’ipotesi terapeutica abbia solide basi scientifiche e razionali e se la parte tossicologica sia compatibile con la sperimentazione del farmaco sull’uomo e l’altro quando si debba fare rilasciare la possibilità di vendita del farmaco in esame dopo una analisi complessiva dei dati preclinici e clinici di efficacia e non tossicità.
L’immagine che segue mostra in riassunto le tappe fondamentali che hanno caratterizzato lo sviluppo della Farmacologia dagli anni Quaranta del secolo scorso. Prima di questa data la Farmacologia si può dire che non esistesse e i farmaci sui quali si poteva contare erano pochissimi, in genere estratti o isolati dalle piante. Tra questi possiamo citare i digitalici, la fenacetina e l’aspirina, i primi sulfamidici e i primi antibiotici come la penicillina (1940), la cocaina, la nicotina, la morfina.
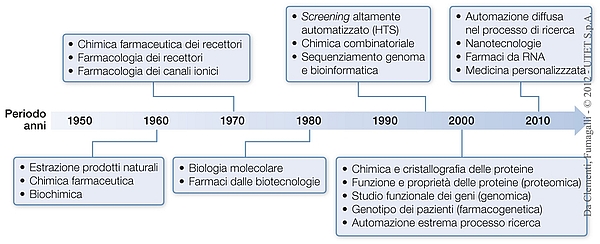 Prima degli anni Cinquanta del secolo scorso i farmaci disponibili erano molto pochi, poco efficaci e con molti effetti collaterali. Solo di alcuni di essi si conosceva il meccanismo d’azione e il loro utilizzo era quindi dettato dalla buona pratica clinica. La rapida crescita delle conoscenze scientifiche e la disponibilità di tecnologie innovative, che hanno caratterizzato la seconda metà del Novecento, hanno contribuito in modo essenziale ai continui profondi cambiamenti nel percorso di ricerca di nuovi farmaci. La schema elenca alcune tappe importanti nella loro successione temporale.
Prima degli anni Cinquanta del secolo scorso i farmaci disponibili erano molto pochi, poco efficaci e con molti effetti collaterali. Solo di alcuni di essi si conosceva il meccanismo d’azione e il loro utilizzo era quindi dettato dalla buona pratica clinica. La rapida crescita delle conoscenze scientifiche e la disponibilità di tecnologie innovative, che hanno caratterizzato la seconda metà del Novecento, hanno contribuito in modo essenziale ai continui profondi cambiamenti nel percorso di ricerca di nuovi farmaci. La schema elenca alcune tappe importanti nella loro successione temporale.
Quali sono le fonti dei farmaci? Tra gli anni Cinquanta e Sessanta del secolo scorso, la fonte più rilevante era costituita dalle farmacopee tradizionali dei vari paesi, basate essenzialmente sull’uso delle piante medicinali, che sono state ampiamente esplorate estraendo dalle piante e dagli animali i principi attivi permettendo così una farmacoterapia più pulita, basata su dosi ripetibili, costante nei risultati ed efficace.
Da questi principi si è poi passati per sintesi chimica a molecole sempre più efficaci, meno tossiche e più selettive. In questi ultimi tempi si sono compiuti passi enormi nella velocità di sintesi di nuovi composti e nel loro screening farmacologico preliminare attraverso la miniaturizzazione degli high-throughput screening.
Quello che ha cambiato drasticamente l’approccio della Farmacologia sono state le recenti acquisizioni nel campo della biologia molecolare e cellulare. La conoscenza del genoma e la proteomica ha moltiplicato i bersagli farmacologici classici, recettori, vie di trasduzione, enzimi, trasportatori, eccetera, permettendo un attacco più selettivo ai bersagli, aumentando quindi gli effetti terapeutici e diminuendo gli effetti collaterali. Inoltre si è dato una dimensione qualitativa e quantitativa alle diversità genetiche degli individui permettendo di meglio identificare come le diverse popolazioni di soggetti reagiscano a un determinato farmaco e dare così inizio alla personalizzazione della terapia, non più una terapia per una patologia, ma una terapia per un ammalato.
La scoperta dei fini meccanismi della regolazione dell’espressione dei geni ha inoltre focalizzato l’attenzione dei farmacologi anche sulla possibilità di influire sulla sintesi dei bersagli aumentandola o diminuendola.
La biologia cellulare ha poi indicato che si può interferire con i processi biologici non solo modificando la proprietà di un recettore, di un canale o di un enzima attraverso farmaci, ma anche interferendo con la sua localizzazione cellulare e con il suo traffico all’interno delle cellule. Inoltre la conoscenza della struttura di molti bersagli farmacologici e del sito di legame dei farmaci attraverso l’uso di metodiche di cristallizzazione e di computer modeling ha permesso il disegno di molecole sempre più specifiche e «intelligenti».
Infine la nanotecnologia e i nuovi materiali stanno dando contributi di grande rilevanza nel settore del drug delivery. Come vedremo più avanti, molte cellule di tessuti del nostro organismo hanno un complemento di recettori molto simile e i farmaci che li colpiscono possono, quindi, avere delle azioni pleiotropiche. Per questo è molto importante poter localizzare l’arrivo dei farmaci nella giusta cellula, nel giusto organo, alla dose corretta e nel giusto tempo. Questo è facile da pensare per organi particolari e facilmente accessibili come l’occhio, il polmone, la cute, il sistema gastrointestinale, ma meno per altri tessuti che possono essere raggiunti solo attraverso la circolazione sanguigna, come il fegato, il cuore, i reni il cervello o eventuali forme tumorali.
Le ricerche recenti della nanotecnologia sul drug delivery hanno permesso di racchiudere il farmaco in nanoparticelle di diversa natura che possono essere indirizzate in modo specifico verso alcuni tessuti o cellule promettendo di far accedere i farmaci ai santuari tissutali finora difficilmente accessibili (per esempio il sistema nervoso centrale), di dirigere le molecole selettivamente sui bersagli (cellule tumorali risparmiando le cellule normali), di modificare in modo favorevole la cinetica dei farmaci nell’organismo (vedi a questo proposito la relazione approfondita del professor Leonida Miglio).
Quali sono le strade nuove percorse dalla Farmacologia di questi ultimi anni? In breve tre aspetti: gli anticorpi monoclonali, la terapia con le cellule, i farmaci derivati dal RNA.
Gli anticorpi monoclonali sono assai importanti perché hanno permesso di riconoscere attraverso famiglie molto omogenee di anticorpi siti specifici di vari antigeni presenti in possibili bersagli terapeutici permettendo l’inibizione o la distruzione di tali antigeni, e quindi delle cellule responsabili di patologie specifiche. La specificità di riconoscimento dell’antigene e l’efficacia terapeutica di questi anticorpi è molto elevata permettendo quindi di attuare interventi farmacoterapeutici importanti e spesso risolutivi in gravi malattie come tumori o malattie autoimmuni.
La terapia cellulare ha permesso di sostituire cellule malate con cellule sane in molti siti dell’organismo umano, si pensi alla sostituzione di cellule leucemiche con cellule ematiche staminali normali, alla ricostruzione di parti di organi e tessuti con cellule staminali normali specifiche dell’individuo malato.
Anche in questo caso la tecnologia è stata di enorme aiuto permettendo di costruire cellule staminali specifiche per ogni tipo di cellule da cellule umane adulte evitando così problemi etici e di attecchimento. In questi casi le cellule nuove possono agire attraverso due meccanismi: possono sostituirsi a quelle malate o rappresentare una fonte, portata in loco, di fattori di crescita e di moltiplicazione che permettono di fare stare meglio le cellule malate. Una forma ancora più spinta di intervento cellulare è quella di introdurre geni sani in cellule che, così manipolate, vengono poi iniettate in organismi che manchino di questi geni o abbiano geni alterati o poco funzionanti. Di queste terapie siamo solo all’inizio, spesso vi sono successi importanti anche se non numerosi, ma purtroppo anche spesso truffe sanitarie da parte di persone moralmente non oneste che sfruttano il dolore per fini economici, promettendo cose che non potranno accadere.
Per ultimo voglio citare i farmaci che derivano dagli RNA, settore emergente che per il momento è all’inizio dello studio clinico. Recentemente si è scoperto che nella cellula esistono piccoli RNA che possono interferire con l’espressione genica a livello post-trascrizionale; queste piccole molecole di RNA, di 20-24 nucleotidi, riconoscono in modo assai specifico molecole di RNA messaggero e possono indurne la degradazione silenziando quindi funzioni anche molto importanti in modo assai specifico; da qui il nome di small interfering RNA. I dati sperimentali e i primi dati clinici sono molto favorevoli per alcune patologie come infezioni virali, tumori, glaucoma e asma, ma la loro applicazione si estenderà rapidamente.
Per la Farmacologia ci si attendeva, così, un periodo di grandi innovazioni che, unite ai progressi compiuti dalla Farmacologia clinica nella sperimentazione sull’uomo e alle nuove impostazioni della ricerca farmacologica industriale, potesse portare significative ricadute terapeutiche.
Questo è avvenuto solo in modo parziale e il numero di nuovi farmaci immesso in commercio per anno non è cresciuto, anzi è rimasto costante, a fronte per ogni farmaco approvato di un aumento vertiginoso dei costi (da 300 a 600 milioni di euro) e del tempo (10-15 anni). Solo una molecola sulle 10.000 potenzialmente attive riesce a entrare in commercio.
Questo ha messo in crisi il vecchio sistema di ricerca innovativa adottato dalle case farmaceutiche fino alla fine del secolo scorso e dato inizio a un rimaneggiamento di tutto il processo farmaceutico basato ora su una divisione dei compiti: l’innovazione, l’ipotesi razionale e i primi dati di efficacia sono prodotti da piccole industrie o da laboratori accademici più agili e più a contatto con il divenire della ricerca, mentre lo sviluppo di processo e clinico rimane appannaggio delle grandi ditte farmaceutiche che dispongono dei capitali ingenti necessari per lo sviluppo industriale e clinico del farmaco.
Alcuni aspetti del meccanismo d’azione dei farmaci
Recettori e le vie di traduzione del segnale
Abbiamo prima accennato che i farmaci agiscono legandosi ad un recettore. Per recettore si intende una molecola la cui funzionalità è modificata dall’interazione con un farmaco. Il concetto di recettore si rifà al principio stabilito da Paul Ehrlich (1854-1915): «corpora non agunt nisi fixata» (le sostanze non agiscono se non si legano). La natura e le funzioni del recettore possono essere svariate (enzima, pompa, canale ionico, eccetera).
Negli ultimi anni si è sviluppata la tendenza a limitare il termine recettore a quelle molecole che in natura sono adibite a trasmettere a una cellula un’informazione portata da una sostanza diffusibile liberata nello spazio extracellulare (detta primo messaggero: neurotrasmettitore, ormone, eccetera).
L’interazione tra farmaco e recettore avviene in siti specifici del recettore che controllano direttamente o indirettamente la funzione del recettore. Si possono avere così farmaci agonisti, se attivano il recettore, o antagonisti, se interferiscono con la sua attivazione. La forza del legame tra farmaco e recettore viene denominata affinità e maggiore è l’affinità, minore è la concentrazione necessaria affinché il farmaco esplichi la sua azione.
In genere un farmaco ha alta affinità per un recettore (ed è questa l’interazione con la quale esplica la sua attività farmacologica), ma a concentrazioni maggiori può attivare altri recettori (ed è questa la causa di possibili effetti collaterali dannosi o tossici).
Il rapporto tra la dose (o la concentrazione) capace di produrre effetti utili (DE) e quella responsabile di effetti collaterali/tossici (per esempio dose tossica, DT, o dose letale, DL) è chiamato indice terapeutico. Perché l’indice sia di qualche utilità, occorre precisare quali sono gli effetti benefici e tossici che si considerano e la loro entità.
In seguito all’interazione tra farmaco e recettore si attiva all’interno della cellula una cascata di eventi biochimici che amplifica l’azione del farmaco con la produzione di secondi e terzi messaggeri intracellulari che sono a loro volta responsabili dell’azione finale del farmaco (si veda l’immagine che segue)
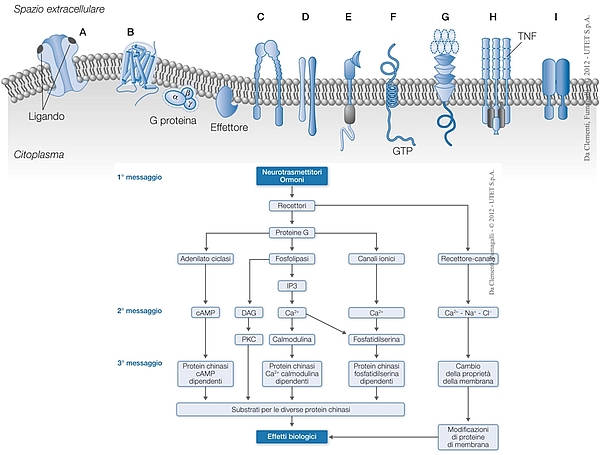 Le classi delle famiglie di recettori di membrana responsabili della comunicazione tra cellule e un esempio della cascata di reazioni biochimiche intracellulari innescata dalla loro attivazione da parte di ormoni e/o neurotrasmettitori (primo messaggero) con l’amplificazione del segnale iniziale attraverso la sintesi di secondi o terzi messaggeri. Dall’interazione iniziale di una molecola con il suo recettore si arriva così alla sintesi di migliaia di molecole che amplificano il segnale. L’effetto biologico finale prodotto dipenderà dalla iniziale interazione ormone-recettore ma soprattutto dalla catena di trasduzione del segnale presente in quella cellula.
Le classi delle famiglie di recettori di membrana responsabili della comunicazione tra cellule e un esempio della cascata di reazioni biochimiche intracellulari innescata dalla loro attivazione da parte di ormoni e/o neurotrasmettitori (primo messaggero) con l’amplificazione del segnale iniziale attraverso la sintesi di secondi o terzi messaggeri. Dall’interazione iniziale di una molecola con il suo recettore si arriva così alla sintesi di migliaia di molecole che amplificano il segnale. L’effetto biologico finale prodotto dipenderà dalla iniziale interazione ormone-recettore ma soprattutto dalla catena di trasduzione del segnale presente in quella cellula.
Spesso le vie di trasduzione del segnale intracellulare attivate da un recettore sono molteplici producendo effetti finali diversi (si veda l’immagine che segue).
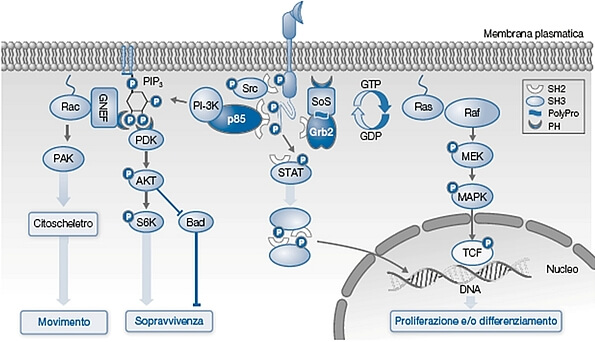
Le vie di trasduzione del segnale per i fattori di crescita di una cellula ben esemplifica la possibilità che uno stesso accoppiamento farmaco-recettore possa attivare funzioni cellulari diverse; in questo caso: movimento, sopravvivenza o proliferazione. Le reazioni intracellulari sono scatenate da fosforilazioni di proteine, la prima delle quali è attuata dalla attivazione di una protein kinasi recettoriale da parte del legame recettore-farmaco. La scelta della funzione attivata dipende da quale tipo di vie di segnalazione è presente in quel momento nella cellula che è determinato dalle esigenze della cellula captate attraverso altre vie recettoriali. Le sigle racchiuse nei cerchi o quadrati identificano le proteine coinvolte, le mezzelune i siti di riconoscimento tra le proteine, P le proteine fosforilate.
La specificità dell’azione di un farmaco nasce quindi dalla specifica interazione farmaco-recettore, ma anche dal tipo di vie di trasduzione del segnale presenti nelle varie cellule. Per esempio l’interazione di farmaci con recettori che attivano la tirosinchinasi può produrre sopravvivenza delle cellule o loro differenziamento o moltiplicazione. La ricerca farmacologica ha prodotto una serie di farmaci che colpiscono anche queste tappe intracellulari permettendo di aggredire in modo più selettivo alcune delle vie di trasduzione del segnale.
Vi sono poi dei recettori che controllano direttamente la traduzione dei geni; sono appunto dei fattori di trascrizione presenti nel citoplasma o nel nucleo delle cellule, per esempio i recettori per gli ormoni steroidei o per gli ormoni sessuali, provocando degli effetti importanti a lungo termine. I farmaci attivi su questo tipo di recettore avranno quindi effetti di lunga durata, e in genere sono attivi su più funzioni fisiopatologiche.
Oltre ai recettori trasduttori di segnale, esistono all’interno e all’esterno delle cellule molti altri bersagli di farmaci che sono in genere più specifici e controllano solo alcune funzioni, vedi per esempio i farmaci antiinfiammatori che colpiscono gli enzimi che sintetizzano le prostaglandine, o le statine che inibiscono un enzima chiave della sintesi del colesterolo.
L’importanza della localizzazione del bersaglio dei farmaci
I recettori hanno una loro precisa localizzazione nelle cellule che è fondamentale per esplicare al meglio la loro funzione. Si pensi per esempio ai recettori responsabili della comunicazione tra cellule, in particolare tra cellule nervose o tra cellule immunocompetenti; a seconda della loro localizzazione all’interno o all’esterno della sinapsi neuronale o della sinapsi immunologica i recettori possono ricevere segnali dalla cellula adiacente o da cellule più lontane e prendere contatto con diverse vie intracellulari di trasduzione del segnale variando così la specificità e la precisione del linguaggio tra cellule.
Per esempio molti neurotrasmettitori catecolaminergici agiscono soprattutto su recettori al di fuori della zona sinaptica e influenzano così il dialogo tra molte cellule che si traduce poi in attivazione o depressione non di uno ma di più circuiti neuronali. I farmaci antidepressivi che interferiscono con questo sistema producono un effetto attivatore di molti circuiti e quindi di attenzione e risveglio.
Altri trasmettitori, per esempio la dopamina, interagiscono con recettori strettamente sinaptici attivando precise vie di comunicazione. Farmaci che interferiscono con questo tipo di segnalazione sono attivi soprattutto su circuiti neuronali specifici, vedi per esempio la DOPA nei nuclei della base, così attiva nel morbo di Parkinson (si veda l’immagine che segue).
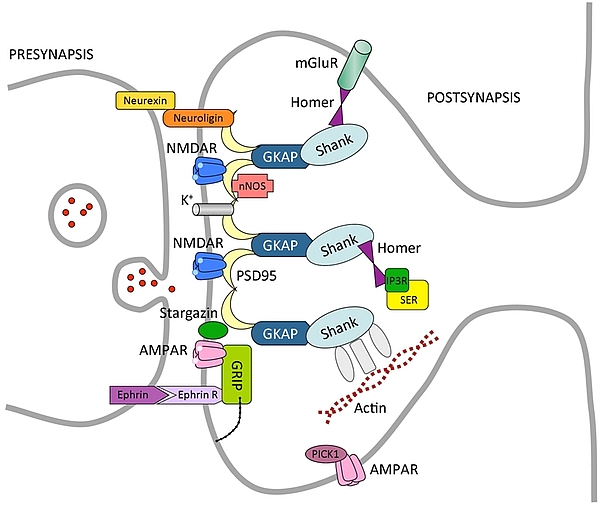 Esempio schematico della localizzazione di recettori in una sinapsi tra neuroni. I recettori (in questo caso per il glutammato, NMDAR, AMPAR) possono essere confinati nella fessura sinaptica assieme ad altre molecole importanti per la trasduzione del messaggio (per esempio stargazina e canali per il potassio K+) e mantenuti in sede attraverso una rete assai complessa di molecole che costituiscono il citoscheletro sinaptico (PSD95, GKAP, Shank, Homer); oppure essere localizzati alla periferia della sinapsi (AMPAR e mGluR). La differente localizzazione rende questi recettori sensibili all’azione di neurotrasmettitori liberati nella sinapsi o provenienti da altre cellule più lontane attraverso il liquido extracellulare.
Esempio schematico della localizzazione di recettori in una sinapsi tra neuroni. I recettori (in questo caso per il glutammato, NMDAR, AMPAR) possono essere confinati nella fessura sinaptica assieme ad altre molecole importanti per la trasduzione del messaggio (per esempio stargazina e canali per il potassio K+) e mantenuti in sede attraverso una rete assai complessa di molecole che costituiscono il citoscheletro sinaptico (PSD95, GKAP, Shank, Homer); oppure essere localizzati alla periferia della sinapsi (AMPAR e mGluR). La differente localizzazione rende questi recettori sensibili all’azione di neurotrasmettitori liberati nella sinapsi o provenienti da altre cellule più lontane attraverso il liquido extracellulare.
Inoltre i recettori non sono dei mattoncini che risiedono in modo permanente sulla o nella cellula, ma possono variare nel numero a seconda delle necessità stesse delle cellule trasferendosi da una zona all’altra della cellula (traffico recettoriale). In particolare i recettori per i neurotrasmettitori a livello neuronale possono diminuire o aumentare di numero a seconda dell’intensità dello stimolo ricevuto modificando quindi la forza del segale trasmesso.
I farmaci stessi possono provocare una variazione del numero di recettori che ne modulano l’azione; in genere un trattamento prolungato con farmaci agonisti provoca una diminuzione di recettori, mentre viceversa gli antagonisti aumentano il numero dei recettori.
La localizzazione e il traffico dei recettori sono governati dalla interazione tra loro e il citoscheletro cellulare attraverso una rete complessa e altamente regolata di molecole.
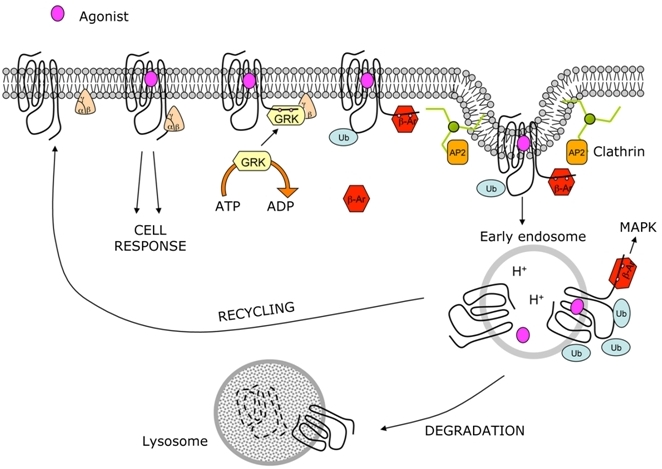 Lo schema presenta un tipico esempio di traffico recettoriale riferito ai recettori accoppiati a proteine G. Dopo l’attivazione del recettore da parte di un agonista recettoriale il recettore attiva la G-proteina con la quale è associato producendo una risposta cellulare. Subito dopo il recettore viene fosforilato e inattivato da una β-arrestina (β-ar) per poi essere internalizzato nella cellula, distrutto nel lisosoma o ricircolato alla membrana. È interessante notare che l’internalizzazione del recettore attiva la β-ar che può essere fonte di un ulteriore segnale intracellulare. I farmaci agonisti diminuiscono il numero di recettori agendo con questo meccanismo.
Lo schema presenta un tipico esempio di traffico recettoriale riferito ai recettori accoppiati a proteine G. Dopo l’attivazione del recettore da parte di un agonista recettoriale il recettore attiva la G-proteina con la quale è associato producendo una risposta cellulare. Subito dopo il recettore viene fosforilato e inattivato da una β-arrestina (β-ar) per poi essere internalizzato nella cellula, distrutto nel lisosoma o ricircolato alla membrana. È interessante notare che l’internalizzazione del recettore attiva la β-ar che può essere fonte di un ulteriore segnale intracellulare. I farmaci agonisti diminuiscono il numero di recettori agendo con questo meccanismo.
Molte patologie del sistema nervoso centrale sono dovute a un cattivo funzionamento di questa rete. Anche su questi processi i farmaci possono intervenire modificando le interazioni tra le proteine cellulari modificando quindi la topologia e la funzione dei recettori.
La terapia personalizzata: la farmacogenetica
Abbiamo accennato, ma è nell’esperienza di tutti, che un farmaco può essere attivo su di una persona, meno in altre, in alcune potrebbe addirittura suscitare risposte non desiderate. Questo è di solito dovuto a differenze individuali nel numero, minore o troppo elevato, dei bersagli dei farmaci o degli enzimi che li metabolizzano oppure a loro piccole modifiche strutturali.
È la differenza tra individui, che riscontriamo pure in gemelli monoovulari, che costituisce la bellezza e la variabilità delle specie animali. Essa è in genere dovuta a piccole mutazioni di qualche base nel DNA di particolari geni che quindi possono tradursi in proteine più o meno differenti oppure in altre modifiche del DNA, metilazioni, o delle proteine che costituiscono la cromatina, acetilazioni degli istoni, che governano e controllano la duplicazione del DNA.
Lo sviluppo tecnologico ha permesso in tempi recenti di rilevare queste minori differenze di sequenze del DNA o della sequenza aminoacidica delle proteine codificate a un prezzo relativamente basso. È stato quindi possibile stabilire correlazioni tra patologie gravi, per esempio tumori della mammella, e caratteri genetici e struttura di alcune proteine tumorali.
In base alla sequenza dei geni che codificano i singoli bersagli dei farmaci o gli enzimi interessanti il loro metabolismo si può ora stabilire quale individuo potrà avere vantaggio da un farmaco, quale sarà la dose farmacologica e il tipo di farmaco più conveniente per lui e quale sarà la prognosi per determinate malattie in base a semplici esami di laboratorio. Questa nuova fase della Farmacologia è chiamata farmacogenetica o farmacoterapia personalizzata. Non si tratta quindi di nuovi meccanismi d’azione dei farmaci, ma di una maggiore corretta loro applicazione.
La Farmacologia, dunque, procede su due strade maestre: la ricerca di nuovi farmaci attraverso la cooperazione tra chimica, biologia cellulare e molecolare e patologia e il miglior uso dei farmaci già disponibili attraverso una migliore identificazione del bersaglio da colpire e una personalizzazione della terapia adeguandola alle caratteristiche dei singoli pazienti.
Non più la malattia da sconfiggere, ma il paziente da curare e del quale prendersi cura.
Vai al sito del Simposio per le slide della Presentazione
Francesco Clementi
(Professore Emerito dell’Università Statale di Milano e Istituto di Neuroscienze del CNR – Milano)
[Le immagini riportate nell’articolo sono tratte dal libro: Farmacologia Generale e Molecolare, a cura di F. Clementi e G. Fumagalli, UTET, 2012.]
Leggi anche
- Emmeciquadro-Speciale n°19: Scienza e tecnologia, un dialogo che continua/ Il Simposio 2015 presso i Laboratori Nazionali del Gran Sasso
- Emmeciquadro-Speciale n°19: Scienza e tecnologia, un dialogo che continua/ Scienza, Tecnologia, Tecnoscienza
- Emmeciquadro-Speciale n°19/ Dalla domesticazione delle piante agli OGM