”for his discoveries of mechanisms for autophagy”
Il Premio Nobel per la Fisiologia o la Medicina 2016 è stato attribuito quest’anno a Yoshinori Ohsumi, scienziato giapponese classe 1945, per le sue ricerche sui meccanismi dell’Autofagìa.
L’autofagia, dal greco autós, (se stesso) e fagèin (mangiare) è un processo di degradazione intracellulare, osservato per la prima volta negli anni Sessanta del secolo scorso. Questa definizione fu, infatti, coniata grazie a studi sul lisosoma, organulo cellulare destinato alla distruzione e al riciclo di componenti cellulari di varia natura, condotti da un altro premio Nobel (1974), il citologo belga Christian de Duve.
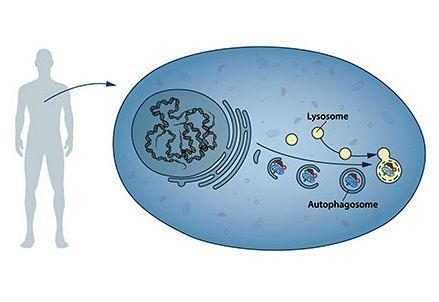
Quello che apparve nelle cellule a de Duve in molte delle sue analisi microscopiche, e in quegli anni pioneristici per la biologia cellulare e molecolare, era una complessa rete di vescicole, caratterizzate da una doppia membrana lipidica (generalmente le vescicole all’interno della cellula sono rivestite da una singola membrana), ripiene di materiale denso e destinate proprio al lisosoma per la loro distruzione.
De Duve le interpretò come una chiara espressione della capacità della cellula di digerire, in piccole porzioni – circoscritte da queste vescicole – il suo stesso contenuto. Una sorta di sistema di trasporto dei materiali di rifiuto, con funzione simile a quella svolta dagli automezzi che trasportano i rifiuti nelle nostre città, ma spesso associato a condizioni sfavorevoli per la vitalità cellulare.
Negli anni successivi e sino alla fine degli anni Novanta, questa fu la visione più condivisa dell’autofagia fra i biologi cellulari e i microscopisti: un fenomeno di movimentazione dei suoi stessi rifiuti che la cellula usa soprattutto (o solamente) quando, sottoposta a stress insopportabili, decide di suicidarsi.
Già, proprio «suicidarsi». Quelli erano, infatti, gli anni in cui si stava facendo strada il concetto di morte cellulare programmata.
Fenomeno cellulare di estrema rilevanza nello sviluppo embrionale, come nella gestione delle condizioni di difficoltà delle cellule e quindi in diverse patologie, la morte cellulare programmata fu riconosciuta in varie forme, da quella controllata da molecole di rivestimento (e quindi soggetta all’influenza delle cellule vicine), a quella gestita dal mitocondrio (e dipendente da regolazioni interne), fino a quella attivata da stress meccanici.
Ebbene, l’autofagia era considerata in quegli anni uno dei vari meccanismi di morte cellulare programmata. Le cellule parevano, infatti, in grado di auto-digerirsi, in piccole porzioni, sino a morirne.
Un giovane scienziato americano, Eric H. Baehrecke, che lavorava in quegli anni sul moscerino della frutta, individuò le vescicole dell’autofagia, nel frattempo definite autofagosomi, nelle ghiandole salivari larvali dell’insetto (un organo destinato alla sparizione nell’adulto) e definì questo processo morte cellulare programmata di tipo II.
L’autofagia era quindi un meccanismo letale.
Nel frattempo, nei laboratori di Tokyo, Yoshinori Ohsumi e il suo gruppo di talentuosi discepoli, si interessava dei processi catabolici (degradativi) del lievito di birra, il Saccharomyces cerevisiae.
In quello e in molti organismi unicellulari, un enorme vacuolo occupa quasi l’intero citoplasma della cellula, sfidando in dimensioni il nucleo pieno di DNA.
 Yoshinori Ohsumi nel suo laboratorio (Credit: Tokyo Institute of Technology)
Yoshinori Ohsumi nel suo laboratorio (Credit: Tokyo Institute of Technology)
Il vacuolo, nei lieviti, è un centro energetico e di segnalazione, una sorta di cisterna in cui varie vescicole confluiscono trasportando contenuti spesso assorbiti dall’esterno e da cui altre nuove vescicole si formano con numerose funzioni di segnalazione e controllo metabolico.
Oltre a seguire con metodiche di biologia cellulare il traffico vescicolare legato al vacuolo nel suo complesso, i ragazzi di Ohsumi identificarono per la prima volta una serie di geni, definiti ATG (AuTophagy-related Genes) che consentivano la formazione degli autofagosomi per il trasporto al vacuolo di blocchi di citoplasma, proteine od organelli, e aggregati di varia natura, allo scopo di degradarli e consentire il riciclo dei loro componenti fondamentali.
Fra i primi geni ATG a essere identificati e a cui vennero assegnate funzioni diverse e specifiche in questo processo sono fondamentali ATG1, ATG6 e ATG8.
Il primo codifica per una fosfochinasi, ovvero un enzima in grado di modificare e attivare, apponendo loro un gruppo fosfato, altre proteine in una cascata di regolazione. Insomma, un attivatore o starter di grande efficacia.
Il secondo genera una molecola adattatrice, una sorta di piattaforma di controllo, il terzo una molecola in grado di aderire come un gancio alla membrana degli autofagosomi, trascinando al loro interno il materiale da incorporare dentro la doppia membrana e destinato alla distruzione.
Da quel momento in poi, due furono le strade che i ricercatori di Ohsumi intrapresero: in primo luogo, l’identificazione e la caratterizzazione di altri geni regolatori dell’autofagia, sia nel lievito sia in altri organismi inclusi i mammiferi e poi, in secondo luogo, la loro inattivazione, per scoprire nei topini di laboratorio la loro funzione specifica e l’eventuale associazione a rilevanti malattie umane. Così, soprattutto Noboru Mizushima e Tamotsu Yoshimori diedero il via all’ultima vera campagna di analisi molecolare di questo nuovo e rivoluzionario processo cellulare.
Oggi ben trentacinque sono i geni che controllano il processo autofagico. Nei mammiferi e quindi nell’uomo, molti dei geni identificati da Ohsumi e i suoi ragazzi sono molto conservati dal punto di vista evolutivo. ATG1 prende il nome di ULK1, ATG6 è BECN1 mentre ATG8 si chiama LC3.
Molti altri sono i regolatori di questi tre. AMBRA1 per esempio, clonato e studiato nel nostro laboratorio romano, ma anche mVPS34, ATG3 e ATG9 e il fattore trascrizionale TFEB che controlla molti di questi a livello nucleare ed è stato scoperto e studiato al TIGEM di Napoli da Andrea Ballabio. ATG5 e ATG7 consentono poi il completamento dell’autofagosoma, e un particolare fosfolipide, la fosfatidiletanolammina, viene apposto in questo processo alle membrane del formando autofagosoma, conferendogli capacità di allungamento e di fusione.
Ma qual è la vera funzione, in tutte le nostre cellule, di questo sofisticato sistema di regolazione della degradazione intracellulare? Davvero si tratta di un meccanismo di morte? In realtà, dagli studi di Ohsumi in poi, questa visione iniziale è stata abbandonata.
Se i primi osservatori rinvenivano autofagosomi in cellule morenti, non era nella maggior parte dei casi a causa del loro ruolo letale, come in un forsennato autocannibalismo, ma era invece un segno tangibile del disperato tentativo della cellula di sopravvivere a stimoli stressori, cercando di eliminare con gli autofagosomi organelli danneggiati e pericolosi, aggregati multiproteici con attività tossica o perfino singole proteine difficili da smaltire con altri mezzi.
Questa importante attività, che chiaramente protegge la cellula da stimoli di morte, ha in condizioni basali un ruolo di ripulitura e riciclaggio, con notevole importanza dal punto di vista bioenergetico. Come si può facilmente immaginare a questo punto, l’autofagia aiuta quindi la cellula a proteggersi e ripulirsi e quindi una sua inattivazione può avere serie ripercussioni per gli organi di cui le cellule fanno parte.
Partendo dai meccanismi molecolari descritti da Ohsumi nel lievito e poi da Mizushima e Yoshimori nei topi, molti altri ricercatori nel mondo hanno dedicato la loro attività allo studio dei ruoli dell’autofagia, o dei suoi difetti, in varie condizioni patologiche.
Naturalmente questo ha conferito agli studi di Ohsumi una rilevanza che lui stesso, per sua stessa ammissione, non aveva immaginato. Beth Levine e Guido Kroemer fra gli altri e poi David Rubinzstein, Vojo Deretic e Skip Virgin hanno associato difetti dell’autofagia a numerose malattie umane, di grandissimo impatto socioeconomico, dal cancro alla neurodegenerazione, passando per le malattie infettive e le autoimmunità.
 Autofagia collegata ad alcuni processi fisiologici e patologici
Autofagia collegata ad alcuni processi fisiologici e patologici
Vi farò qui due esempi notevoli. In primo luogo i tumori.
Se un gene autofagico non funziona, è mutato, gli autofagosomi non possono formarsi, i contenuti da degradare rimangono nella cellula e alcuni di questi, come i mitocondri, possono generare specie reattive dell’ossigeno in eccesso e indurre danno al DNA e instabilità cromosomica. La base fondante dei tumori, appunto.
Al contrario, cellule tumorali che hanno un’autofagia che funziona in modo eccellente (come nella maggior parte dei tumori umani), sono in grado di reagire alla chemioterapia, sfruttando il processo autofagico come insostituibile fonte di energia. Non a caso, molti approcci terapeutici innovativi in fase di sperimentazione, puntano all’inibizione dell’autofagia per la soppressione tumorale. Poi le malattie neurodegenerative, quali la corea di Huntington. L’autofagia nei neuroni garantisce la loro ripulitura da aggregati multiproteici di Huntingtina mutata, che purtroppo caratterizza quella malattia devastante. In questo caso, spingere l’autofagia a livelli elevati garantirebbe una efficiente rimozione dell’agente tossico.
In conclusione, quelle prime analisi molecolari condotte da Ohsumi sui geni autofagici sono state fondamentali per lo sviluppo successivo degli studi sull’uomo e su un’ampia gamma di gravi malattie.
L’Accademia di Stoccolma ha spessissimo premiato la ricerca di base, nobilitando oscure ricerche, spesso su sistemi modello diversi dai mammiferi, che hanno poi costituito l’incipit di scoperte cruciali per la salute umana. Il premio Nobel a Yoshinori Ohsumi è quindi meritatissimo.
Il fisico Max Planck in un suo celebre aforisma disse knowledge precedes application, la conoscenza precede l’applicazione. Non dovremmo mai dimenticarlo.
Francesco Cecconi
(Professore Ordinario di Biologia dello Sviluppo presso l’Università di Roma Tor Vergata)
© Pubblicato sul n° 63 di Emmeciquadro