Come le alghe salvarono il mondo da un triste destino.
Il mondo che noi oggi conosciamo è caratterizzato da una elevata biodiversità e una atmosfera caratterizzata da un basso tenore di CO2 (0.04%) e una elevata concentrazione di O2 (21%).
Alle origini della vita sulla Terra, tuttavia, la situazione era assai diversa, con una modesta biodiversità, pochissimo O2 e grandi quantità di CO2.
In questo contesto, apparvero i primi organismi fotosintetici, presumibilmente incapaci di produrre O2. In questi organismi, la molecola responsabile dell’evento fotochimico primario, ovvero dell’utilizzo dell’energia elettromagnetica, utilizzava composti ridotti dello zolfo o altre molecole con un potenziale redox sufficientemente negativo per rifornire le molecole fotochimiche di elettroni.
Modificazioni nelle caratteristiche dei sistemi preposti alla conversione dell’energia elettromagnetica in energia chimica condussero alla comparsa di organismi che erano in grado di utilizzare H2O come donatore di elettroni per le molecole responsabili dell’evento fotochimico primario.
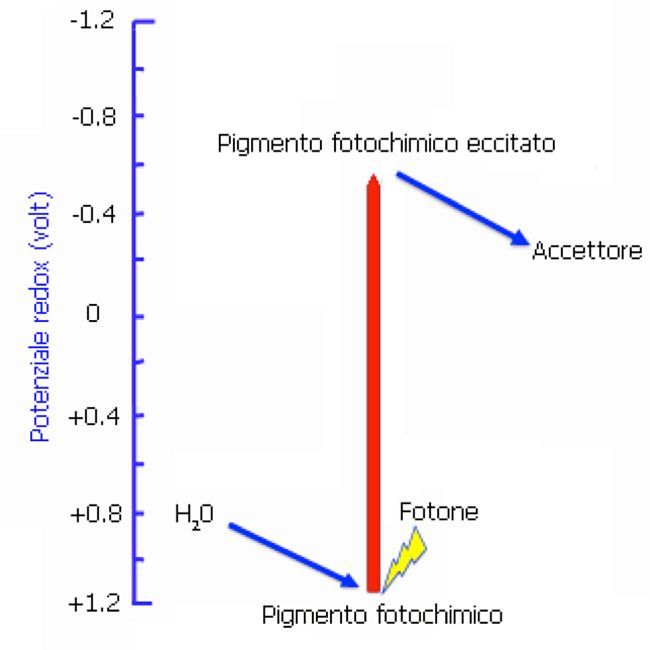 Fotosintesi ossigenica. Quando il pigmento fotochimico, in seguito alla ricezione di un fotone si eccita e poi cede un elettrone a un accettore, la sua forma ossidata deve ricevere un elettrone perché la fotochimica possa ripetersi. Se il donatore di questo elettrone è l’acqua (4 volte da 2 molecole di H2O), viene rilasciato O2
Fotosintesi ossigenica. Quando il pigmento fotochimico, in seguito alla ricezione di un fotone si eccita e poi cede un elettrone a un accettore, la sua forma ossidata deve ricevere un elettrone perché la fotochimica possa ripetersi. Se il donatore di questo elettrone è l’acqua (4 volte da 2 molecole di H2O), viene rilasciato O2
Questo condusse alla produzione di O2 come prodotto di scarto del processo (fotosintesi ossigenica).
Questa invenzione evolutiva non è energeticamente banale, in quanto la sottrazione di elettroni dall’acqua, il cui potenziale redox (0.82 V) richiede accettori con potenziali redox ancora più positivi, che non sono frequenti in natura.
La datazione della comparsa degli organismi con fotosintesi ossigenica non può essere basata su fossili, in quanto non vi sono fossili di questi organismi sufficientemente antichi sulla cui attribuzione vi sia consenso.
Tuttavia, alcuni indicatori quali la presenza di stromatoliti fossili, di derivati di steroli tipici delle membrane di procarioti ossigenici (2-metilopani), i rapporti tra gli isotopi stabili del C, fanno ritenere che la fotosintesi ossigenica sia apparsa già tra il tardo Archeano (3 miliardi di anni fa) e l’inizio del Proterozoico (2.5 miliardi di anni fa) (si veda l’immagine nella pagina seguente per una descrizione della scala geologica temporale).
 Scala geologica temporale secondo la US Geological Association. Ma = milioni di anni dal presente
Scala geologica temporale secondo la US Geological Association. Ma = milioni di anni dal presente
Al tempo della comparsa della fotosintesi ossigenica, l’O2 prodotto veniva consumato dai numerosi siti riducenti presenti sulla Terra. Soltanto dopo la saturazione di questi siti, l’O2 poté iniziare ad accumularsi in atmosfera.
La presenza di apprezzabili quantità di O2 in atmosfera può essere stimata utilizzando una serie di indicatori. Per esempio, l’andamento temporale del frazionamento massa-indipendente degli isotopi dello zolfo, in solfuri e solfati, suggerisce che fino a circa 2.4 miliardi di anni fa il tenore atmosferico di O2 fosse < 10-5 volte quello attuale; la formazione di cospicui depositi di Fe3+, ossidato dalla presenza di O2 a partire dal molto più solubile Fe2+, si riscontra in depositi di arenaria di circa 2 miliardi di anni fa; la pirite e l’uraninite, che non possono formarsi in presenza di O2 >~ 1%, non si trovano in sedimenti posteriori a 2.4 miliardi di anni fa; la presenza di eterocisti in organismi azoto fissatori, con la funzione di isolare gli enzimi sensibili all’O2 preposti alla fissazione del N2 in NH4+, si può datare, mediante orologi molecolari, tra 1.7 e 2.1 miliardi di anni fa.
L’insieme di questi indicatori conduce a concludere che l’accumulo di cospicue quantità di ossigeno in atmosfera non si verificò prima di 2.4-2.0 miliardi di anni fa.
L’accumulo di O2 in atmosfera determinò numerose importanti conseguenze, per gli organismi viventi. Per effetto dell’interazione con radiazioni UVC. L’O2 portò alla formazione dello strato di ozono nella stratosfera, che schermando le radiazioni UVB rese più agevole la colonizzazione della superficie terrestre e consentì di deviare verso altre funzioni risorse precedentemente dedicate alla difesa dagli UV e dai danni da essi procurati.
La presenza dell’O2 consentì anche l’avvento della respirazione aerobia, assai più efficace della fermentazione anaerobia. La maggior disponibilità energetica che ne conseguì, presumibilmente alimentò l’incremento di complessità funzionale e strutturale degli organismi e, in ultima analisi, l’incremento di biodiversità sul pianeta.
Non è dunque sorprendente che nel medio Proterozoico (1.1 – 0.9 miliardi di anni fa) siano apparse le alghe eucariotiche, in seguito a eventi endosimbiotici primari.
Le informazioni che abbiamo sull’ossigenazione dell’atmosfera sono dunque numerose e concordanti. Non è invece certo che anche gli oceani del medio Proterozico fossero ossigenati.
Canfield ha proposto che nel periodo compreso tra 1.85 e 0.85 miliardi di anni fa, l’oceano fosse caratterizzato da uno stato piuttosto sottile di acque ossigenate sotto le quali vi era un grande volume di acque ricche di H2S e pressoché anossiche [vedi Anbar and Knoll 2002. Science 297: 1137-1142 per una descrizione dell’evoluzione della chimica degli oceani].
Le prove a supporto di questa idea, per quanto da qualcuno contestate, sono numerose e, dal punto di vista di chi scrive, convincenti.
In questo ambito temporale, la produzione primaria era probabilmente molto bassa a causa soprattutto della carenza di Fe (che tendeva a precipitare con il solfuro in forma di pirite), che determinava una difficoltà nella fissazione e assimilazione dell’azoto (gli enzimi coinvolti in queste vie hanno un’elevata domanda di Fe).
Alla fine del Proterozoico, la progressiva ossigenazione degli oceani e dunque la conversione del H2S in solfato e il frazionamento del supercontinente Rodinia (con un conseguente maggiore contributo della erosione delle terre emerse al rifornimento di nutrienti in mare) condussero a un incremento della produzione primaria.
Il Neoproteozoico vede anche l’affermarsi delle alghe verdi come produttori primari (fino a quel momento, la fotosintesi era in grande prevalenza compiuta da cianobatteri). Si ritiene che in questo periodo le simbiosi secondarie diedero vita ad altri gruppi algali, che però divennero quantitativamente rilevanti solo più tardi.
E così si arrivò al Paleozoico: da qui in poi le condizioni di ossigenazione degli oceani non cambieranno (se non localmente). L’inizio del Paleozoico vede un notevole incremento di biodiversità e complessità funzionale degli organismi. Questa diversificazione dei viventi presumibilmente deriva da una ecologia permissiva, nel periodo immediatamente precedente, nella quale ecospazi poco densamente occupati consentirono a numerose varianti di sopravvivere, fornendo la materia prima per le radiazioni evolutive successive. L’incremento di complessità funzionale degli animali comportò un aumento della pressione predatoria e della pressione selettiva da essa rappresentata.
In differenti momenti della storia della Terra, il rapporto O2:CO2 ha subito degli incrementi. Particolarmente evidente è stato quello del Carbonifero. Le conseguenze di questo fatto sono di importanza pivotale per la produzione primaria globale.
La Rubisco l’enzima che catalizza la sintesi di nuovo carbonio organico, è infatti molto sensibile a variazioni nel rapporto O2:CO2, poiché O2 e CO2 sono inibitori competitivi nel sito attivo di questo enzima: a seconda che sia l’O2 o la CO2 a reagire nel sito attivo della Rubisco (con lo zucchero a cinque atomi di carbonio, ribulosio bisfosfato) si avrà la perdita o l’aumento di carbonio organico nella cellula e, in ultima analisi, in tutta la biosfera.
Dunque, l’incremento del rapporto O2:CO2 determinò una forte pressione selettiva in favore di quegli organismi che riuscivano a mitigare gli effetti avversi dell’incremento del rapporto O2:CO2.
La Rubisco è un enzima assai sensibile a sia pur minime modificazioni del suo sito attivo (piccoli cambiamenti spesso portano all’incapacità dell’enzima di fissare la CO2 in nuova materia organica). Solo modesti miglioramenti della sua capacità di selezionare CO2 piuttosto che O2 sono dunque stati ottenuti mediante modificazioni della sua sequenza genica.
La pressione selettiva portò invece alla comparsa di meccanismi tesi a incrementare la concertazione di CO2 e quindi a diminuire il rapporto O2:CO2 in prossimità di siti attivi della Rubisco: i cosiddetti meccanismi di concentrazione della CO2.
Tra la fine del Paleozoico (periodo Permiano) e l’inizio del Mesozoico (periodo Triassico), ebbe luogo la più massiccia estinzione di massa ad aver interessato il pianeta. Il 90 % di tutte le specie marine scomparve. Tutto avvenne molto rapidamente (in meno di 1 milione di anni), per cause su cui non vi è assoluto consenso. Di nuovo gli oceani si svuotarono: la vita poté riprendere il suo percorso dando spazio a organismi con caratteristiche adatte al nuovo mondo.
Nel Mesozoico, forse anche grazie all’iniziale disponibilità di nicchie ecologiche e alla poca competizione in oceani poco popolati, si osservò un profondo cambiamento nel tipo di produttori primari prevalenti negli oceani.
Mentre fino ad allora la fotosintesi era stata prevalente appannaggio di alghe verdi (con le clorofille a e b come principali pigmenti fotosintetici) e cianobatteri (con clorofilla a e ficobiline), dal Mesozoico si affermarono organismi fotosintetici il cui cloroplasto era derivato per endosimbiosi secondaria da alghe rosse e conteneva clorofille a e c.
I produttori primari che da questo momento divennero prevalenti negli oceani possedevano cloroplasti con una composizione elementale più adatta a una vita in ambienti molto ossigenati (ovvero con maggiore abbondanza dei metalli più disponibili in ambienti ossici) e avevano un maggiore contenuto cellulare di S, elemento la cui concentrazione oceanica, contestualmente, aumentò in modo rilevante (si veda l’immagine che segue per le variazioni del solfato negli oceani).
Tra questi organismi le diatomee, i coccolitoforidi, le dinoflagellate, che oggi dominano gli oceani.
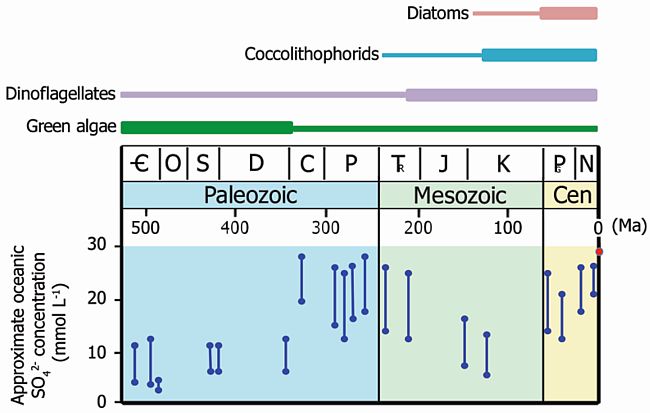
Andamento temporale delle concentrazioni oceaniche di solfato (da Ratti et al. 2011. Geobiology 9:301-312)
Esperimenti condotti in laboratorio hanno dimostrato che la chimica degli oceani del Mesozoico ebbe tra le sue conseguenze una modificazione nella qualità della biomassa del fitoplancton, che divenne mediamente più energetica.
Di conseguenza, gli organismi che di fitoplancton si nutrivano ebbero a disposizione maggiori quantità di energia; questo conferì loro la possibilità di sostenere un incremento di complessità strutturale e una maggiore attitudine predatoria: la pressione di pascolo dei micropredatori sulle alghe del fitoplancton aumentò.
Tale pressione condusse probabilmente alla selezione di quegli organismi con maggiori capacità difensive (fossero essi muniti di difese chimiche o di armature che offrivano una resistenza meccanica all’aggressione dei predatori). Fu probabilmente questa sequenza di eventi che portò all’affermarsi dei taxa oggi prevalenti negli oceani.
Tra il Mesozoico (Cretaceo) e il Cenozoico (Terziario), ebbe luogo il famoso evento che portò all’estinzione dei dinosauri sulla terra ferma. Nel fitoplancton, numerosi taxa di coccolitoforidi si estinsero; pochi taxa di diatomee e dinoflagellate scomparvero.
Entro l’inizio dell’Eocene (55 milioni di anni fa) i gruppi di alghe principali tornarono al livello di diversità precedente all’evento di estinzione. In mare dunque, specie nel caso delle alghe, quello che uccise i dinosauri ebbe un impatto modesto.
E così si arrivò ai giorni nostri, con alcuni altri eventi che non abbiamo qui il tempo di trattare (per esempio la comparsa delle barriere coralline).
Da questa storia risulta evidente come la comparsa della fotosintesi ossigenica sia stata motore dell’incremento di complessità della biosfera e abbia fornito l’energia e la materia prima per la sua diversificazione ed espansione.
Glossario
Endosimbiosi – Processo di predazione incompleto che porta alla acquisizione degli organismi predati e alla loro conversione in organelli cellulari (I.e. mitocondri e cloroplasti). Le endosimbiosi primarie diedero origine a eucarioti fotosintetici per acquisizione da parte di organismi eterotrofi di procarioti fotosintetici che diedero luogo ai primi cloroplasti. Nelle endosimbiosi secondarie, l’acquisizione dei cloroplasti avviene per acquisizione di organismi derivati da endosimbiosi primarie (quindi già eucarioti).
Eterocisti – cellule specializzate proprie di cianobatteri coloniali. Le eterocisti non sono capaci di fotosintesi e sono invece capaci di convertire l’azoto molecolare, N2, in azoto ammoniacale. È un processo esclusivo dei procarioti ed energeticamente molto dispendioso. L’ossigeno è tossico per gli enzimi che catalizzano la fissazione dell’azoto. In ultima analisi, la fissazione dell’azoto determina il flusso di N nella materia vivente.
Fitoplancton – porzione del plancton costituita da organismi fotosintetici.
Fotosintesi ossigenica – processo in cui l’energia luminosa viene impiegata per la fissazione di carbonio inorganico in composti organici e in cui H2O viene utilizzata come donatore di elettroni e protoni, con il conseguente rilascio di O2.
Fotosintesi anossigenica – processo in cui l’energia luminosa viene impiegata per la fissazione di carbonio inorganico in composti organici e in cui vengono utilizzati donatori di elettroni e protoni diversi dall’acqua, cosicché non si ha il rilascio di O2.
Meccanismi di concentrazione della CO2 – Meccanismi di pompaggio di C inorganico energia-dipendenti verso il sito attivo della rubisco.
Produttori primari – organismi fotosintetici (in prevalenze) che determinano la via di ingresso del C inorganico nella materia organica. Sui produttori primari si innestano le reti trofiche.
Rubisco – Ribuloso 1,5-bisfosfato carbossilasi/ossigenasi. Probabilmente l’enzima più abbondante del pianeta. È responsabile della catalisi della reazione di fissazione della CO2 nella materia organica. La Rubisco catalizza anche la reazione di fissazione dell’O2, che però non porta all’incremento di materia organica e che anzi, per ragioni biochimiche, porta alla perdita di C organico.
Vai al PDF di questo contributo
Mario Giordano
(DISVA, Università Politecnica delle Marche, Ancona, Italia. E-mail: [email protected])
© Rivista Emmeciquadro
Leggi anche
- Speciale n° 30: Formazione ed evoluzione dell’ambiente: misure e modelli/ Il Simposio 2016 presso i Laboratori Nazionali del Gran Sasso
- Speciale n° 30: Formazione ed evoluzione dell’ambiente: misure e modelli/ Una catastrofe ecologica: la fotosintesi ossigenica
- Speciale n° 30: Formazione ed evoluzione dell’ambiente: misure e modelli/ Le variazioni climatiche nella realtà storica
