Lei ha guidato il gruppo di ricerca, in gran parte costituito da italiani, che ha esplorato il meccanismo di funzionamento della VE-caderina (Vascular-Endothelial cadherin) – da lei scoperta dieci anni fa – una delle proteine di adesione che contribuiscono a tenere unite le cellule dell’endotelio vascolare. Da dove è nata inizialmente la sua ricerca sulla VE-caderina? E come è arrivata alla sua identificazione?
Come spesso succede in ricerca, le scoperte più nuove arrivano inaspettatamente. In questo caso stavamo studiando delle molecole di adesione e, lavorando sulle cellule endoteliali che tenevamo in coltura, abbiamo trovato un anticorpo che, nella zona di contatto tra una cellula e l’altra, dava una colorazione molto particolare speciale, unica.
Era una tipica situazione di serendipity; ci siamo incuriositi, ci siamo fatti delle domande e, come succede appena si vede un meccanismo nuovo, ci siamo appassionati. Abbiamo lavorato molto per cercare di identificare la proteina che dava questa colorazione particolare; poi abbiamo capito che è una proteina che si organizza attorno al bordo della cellula e fa da cerniera lampo, tenendo legata una cellula all’altra; in particolare, al microscopio questa marcatura così precisa si vedeva solo nelle cellule che erano a contatto una con l’altra. Abbiamo purificato la proteina e l’abbiamo identificata, poi abbiamo identificato il gene che la codifica e l’abbiamo inattivato in topi da esperimento.
Da questo lavoro abbiamo osservato che la VE-caderina è necessaria perché si organizzi il sistema vascolare. Infatti, inattivando il gene, veniva meno la coesione tra le cellule che non si organizzavano a formare i vasi e gli embrioni morivano molto presto. Quando il cuore degli embrioni cominciava a battere e a mandare il sangue in circolo con una certa pressione, i vasi embrionali si disgregavano, la rete vascolare collassava e gli embrioni morivano in utero perché gli organi in formazione non ricevevano il nutrimento e l’ossigeno necessario.
Questa è stata la prima evidenza dell’importanza di questa proteina.
L’identificazione della VE-caderina come fattore di coesione è avvenuta nell’ambito di uno studio sull’angiogenesi tumorale, mostrando un ruolo chiave nel processo di vascolarizzazione dei tumori; la scoperta poteva bastare per una applicazione terapeutica mirata: impedendo la formazione di VE-caderina si può impedire o rallentare la crescita del tumore. Invece la ricerca è andata avanti, anzi si è approfondita. Qual è stato lo stimolo per ampliare l’orizzonte dell’indagine?
Nell’ambito della ricerca di nuove terapie contro i tumori che si svolge presso IFOM, la prima applicazione della scoperta è stata quella di vedere se si poteva, manipolando la sua espressione o attività, inibire la crescita dei vasi tumorali.  Infatti, il tumore per crescere ha bisogno di vasi che gli portino sangue e ossigeno e gli permettano di proliferare; l’idea di base è stata quella di sviluppare farmaci anti angiogenici, in grado cioè di inibire la vascolarizzazione, per «tagliare i viveri» alle cellule tumorali. In particolare, abbiamo ipotizzato che, se fossimo riusciti a bloccare la VE-caderina nei vasi del tumore, saremmo riusciti a disgregarli come nell’embrione; per questo abbiamo sviluppato una serie di anticorpi che bloccavano la VE-caderina; alcuni di questi sono specifici per i vasi del tumore e, come ipotizzato, ne inducono la regressione.
Infatti, il tumore per crescere ha bisogno di vasi che gli portino sangue e ossigeno e gli permettano di proliferare; l’idea di base è stata quella di sviluppare farmaci anti angiogenici, in grado cioè di inibire la vascolarizzazione, per «tagliare i viveri» alle cellule tumorali. In particolare, abbiamo ipotizzato che, se fossimo riusciti a bloccare la VE-caderina nei vasi del tumore, saremmo riusciti a disgregarli come nell’embrione; per questo abbiamo sviluppato una serie di anticorpi che bloccavano la VE-caderina; alcuni di questi sono specifici per i vasi del tumore e, come ipotizzato, ne inducono la regressione.
Andando avanti nel lavoro abbiamo visto che questa proteina, oltre ad agire come molecola di adesione per le cellule endoteliali, è anche in grado di trasferire dei segnali e questo è un aspetto interessante perché introduce l’idea che le cellule comunicano toccandosi l’una con l’altra.
Siamo anche riusciti a definire il meccanismo attraverso cui il segnale viene trasmesso. La VE-caderina è legata a un partner, un fattore trascrizionale che riusciti a bloccare la VE-caderina nei vasi del tumore, saremmo riusciti a disgregarli come nell’embrione; per questo abbiamo sviluppato una serie di anticorpi che bloccavano la VE-caderina; alcuni di questi sono specifici per i vasi del tumore e, come ipotizzato, ne inducono la regressione.
Andando avanti nel lavoro abbiamo visto che questa proteina, oltre ad agire come molecola di adesione per le cellule endoteliali, è anche in grado di trasferire dei segnali e questo è un aspetto interessante perché introduce l’idea che le cellule comunicano toccandosi l’una con l’altra. Siamo anche riusciti a definire il meccanismo attraverso cui il segnale viene trasmesso.
La VE-caderina è legata a un partner, un fattore trascrizionale che si chiama beta catenina. La organizzazione dei contatti cellula-cellula modula il distacco di questo fattore dalla VE-caderina e il suo passaggio all’interno del nucleo dove regola l’espressione di una serie di geni specifici.
In generale, pensiamo che l’instaurarsi dei contatti tra cellule endoteliali induca le cellule a stabilizzarsi e le renda meno sensibili alla morte programmata, più capaci cioè di contrastare stimoli tossici che potrebbero danneggiarle.
È molto bello, anche da un punto di vista evolutivo, che le cellule endoteliali, che sono in un unico strato e costituiscono la parete interna dei vasi, trovino la loro condizione ottimale quando si forma un pavimento omogeneo e continuino ad aggiustarsi mandando segnali di stabilità.
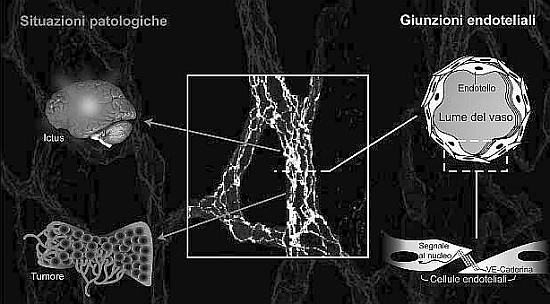
Uno di questi segnali regola la sintesi della claudina 5, una proteina che media una giunzione ancora più stretta tra le cellule stabilizzandole ulteriormente. In altre parole, mentre la VE-caderina è solo una molecola di aderenza, la claudina 5 organizza una giunzione stretta, stringendo ancora di più il contatto. L’inattivazione del gene della claudina 5 (con la tecnica chiamata knock out) provoca emorragia perché i vasi non sono abbastanza forti. Senza la VE-caderina l’embrione muore perché manca il primo e necessario mediatore di adesione, mentre, se si inattiva il gene della claudina 5, i vasi si organizzano ma sono molto fragili e i neonati muoiono per emorragia cerebrale.
In un contributo pubblicato su Nature Cell Biology del 29 luglio 2008 dal titolo Endothelial adherens junctions control tight junctions by VE-cadherin-mediated upregulation of claudin-5 avete annunciato una nuova scoperta: il percorso specifico attraverso cui la VE-Caderina, attiva la produzione della claudina 5. Che significato e quali potenzialità applicative ha questa nuova scoperta?
Per chi come noi si occupa di vasi, queste sono le nuove direzioni della ricerca: rendere i vasi molto più stabili per impedire un aumento incontrollato di permeabilità e per prevenire emorragie. Questo è importante anche per patologie diverse dai tumori, come per esempio l’ictus emorragico che ha una mortalità elevatissima (più dell’80%) e si verifica quando si ha un aumento incontrollato di pressione sanguigna e i vasi, troppo deboli, non riescono a resistere efficacemente.
Anche nell’ictus così detto ischemico (legato alla placca arteriosclerotica e alla formazione di emboli che bloccano il circolo cerebrale) la possibilità di rendere i vasi più stabili è importante. Infatti, l’ischemia è seguita da edema e cioè i vasi non riescono più a controllare la permeabilità perché le giunzioni tra cellule endoteliali sono deboli.
Quindi, se si riuscisse a trovare un agente terapeutico che limiti l’aumento di permeabilità si potrebbe arrivare a ridurre il danno cerebrale. Da questi studi recenti abbiamo visto che, modificando il segnale indotto dal fattore di trascrizione che abbiamo descritto sopra, la beta catenina, si possono rendere le giunzioni più forti e ricostituire una con-dizione di stabilità vascolare.
Queste osservazioni possono essere importanti anche per i tumori. Infatti, ridurre la crescita dei vasi è utile soprattutto quando il tumore è molto piccolo, mentre quando il tumore cresce la situazione è molto più difficile perché i vasi sono molto instabili, fanno frequenti emorragie che portano alla formazione di zone necrotiche che impediscono l’accesso alla chemioterapia.
Si stanno pertanto progettando diversi tipi di intervento terapeutico che permettano cioè non solo di indurre la regressione dei vasi, ma in alcune condizioni anche la loro normalizzazione.
Nell’immaginario collettivo il ricercatore che opera a livello molecolare usa tecniche molto avanzate (voi avete usato la tecnologia del DNA microarray e l’imaging cellulare ad alta risoluzione) ma affronta i problemi alla radice. Voi avete dichiarato che la VE-caderina agisce in modo più complesso di quanto immaginavate inizialmente. La ricerca molecolare può compiersi senza fare riferimento a quello che accade a livello delle cellule o dell’intero organismo?
La natura è estremamente complessa e dobbiamo convincerci che ne conosciamo soltanto una minima parte.
Infatti, per quanto per un paziente sia difficile da comprendere, bisogna accettare che i medici non sanno tutto e non sanno risolvere tutti i problemi. Inoltre, quello che il ricercatore normalmente fa è spezzare il quadro, come in un puzzle: quando è tutto montato si vede un bellissimo disegno, che è fatto però di tanti piccoli pezzi.
È molto difficile studiare l’organismo nel suo insieme perciò quello che si può fare è dividerlo in tanti pezzetti diversi che vengono studiati separatamente, ma in profondità, il passo successivo è quello di ricomporre il puzzle, rimettere il quadro insieme ma con più dettagli e conoscenze.
Nel nostro caso, per capire quanto è importante la VE-caderina, abbiamo dovuto prima identificarla, poi spezzarla per vedere il ruolo funzionale di ogni pezzetto della proteina, poi studiare la sua attività nelle cellule isolate e infine tornare all’embrione e vedere cosa succede inattivando il gene nell’intero organismo vivente.
Ci sono dei progetti di ricerca che mettono insieme ricercatori di tante discipline diverse: ci vuole il clinico accanto a chi fa ricerca di base sulla cellula o sul gene isolato eccetera, ma occorre anche il fisico, il matematico, il chimico.
Poiché purtroppo non siamo Leonardo da Vinci che aveva una capacità eclettica spettacolare è ovvio che dobbiamo lavorare in team in modo che ognuno metta in gioco tutta la sua esperienza, a un altissimo livello di specializzazione.
Lei ha dichiarato che «in controcorrente rispetto alla tendenza a ‘settorializzare’ la ricerca scientifica il risultato di questo studio dimostra il valore trasversale della ricerca di base che, lavorando sui meccanismi biologici fondamentali, perviene a scoperte ricche di implicazioni applicative valide per molteplici aree di indagine apparentemente lontane, aprendo la strada allo sviluppo di strategie terapeutiche innovative per patologie diverse nella loro manifestazione ma accomunate da una stessa disfunzione a livello cellulare.» In tutti i casi una scoperta sui meccanismi biologici fondamentali apre strade nuove? A quali condizioni?
Sono profondamente convinta che è assolutamente necessaria una ricerca di base di alto livello per avere una ricerca traslazionale (applicativa/terapeutica) innovativa. Per esempio, la agenzia Human frontieres finanziata dalla comunità europea, dal Giappone, dagli Stati Uniti e dall’Australia, supporta solo progetti interdisciplinari e strettamente di base perché solo attraverso la scoperta di nuovi meccanismi biologici si possono trovare nuove applicazioni terapeutiche. Altrimenti saremo costretti a rifinire solo quello che c’è già.
Questa agenzia, per esempio, ha finanziato un progetto di studio dei meccanismi con cui i pipistrelli (mammiferi notturni) si orientano: emettono ultrasuoni e usano i loro organi sensori per monitorare l’ambiente intorno a sé; un gruppo lavorava sugli effetti biologici dei sensori, un altro sugli aspetti biofisici del fenomeno.
Ci si può domandare perché investire in un progetto così lontano da una finalizzazione per la salute dell’uomo; in realtà questo progetto può avere delle implicazioni molto importanti per i ciechi. Infatti, se si riescono a individuare i meccanismi con cui si riceve e si trasmette lo stimolo dagli organi sensori al sistema nervoso centrale si potrebbero sviluppare nuovi strumenti per «sentire» gli ostacoli circostanti anche senza la vista. In questo caso si è lasciata molta libertà alla ricerca di base lasciando aperti tutti gli aspetti di tipo applicativo.
In generale credo che i ricercatori abbiano cervelli diversi, possano, cioè, usare strumenti intellettuali diversi per studiare i problemi: per esempio c’è chi si concentra solo su una proteina e magari la studia per tutta la sua vita, c’è chi è affascinato da un tipo cellulare e ci si appassiona, o quello che riesce a vedere l’organismo nel suo insieme, per esempio gli embriologi.
Ci sono poi scienziati particolarmente capaci di fare la connessione tra i risultati della ricerca di base e le applicazioni terapeutiche, quelli che riescono a vedere nei dati sperimantali le possibili implicazioni per le diverse patologie nell’uomo. Perciò è importante che queste persone possano lavorare insieme, su progetti che non siano solo finalizzati a identificare un farmaco o una terapia. Altrimenti saremo sempre condannati a una ricerca vecchia che può solo affinare cose già note, ma che non scopre niente.
Purtroppo i finanziamenti a disposizione sono soprattutto diretti a una ricerca di tipo finalizzato, che può servire immediatamente, ma che non apre strade nuove. Invece, sarebbe utile avere supporto per una ricerca di base «libera» il cui controllo, con parametri rigorosi, possa essere solo se è fatta bene o male e non necessariamente se sarà utile nell’immediato o no.
Credo che sia un errore profondo soprattutto per il nostro Paese, non investire in ricerca di base, e non lasciare i ricercatori liberi di sviluppare idee nuove perché è da lì che verrà negli anni futuri la capacità di competere.
Quindi la condizione per aprire strade nuove è saper lavorare in gruppo?
Io credo che avere la possibilità di combinare cervelli e attitudini diverse possa dare una marcia in più. Il ricercatore di base può fare scoperte importanti, ma magari non riesce a vederne subito la applicazione; se è affiancato da chi invece vede questa potenzialità e la implementa, si può andare molto più veloci ed essere molto più efficaci.
Queste diverse competenze, però, devono stare vicine e instaurare un dialogo e uno scambio continuo. La vicinanza di diversi atteggiamenti è fondamentale: linguaggi e strutture mentali diverse devono imparare a parlarsi continuamente.
È importante comunicare con il pubblico?
È importante che la scienza e le varie scoperte scientifiche vengano comunicate sempre e nella maniera più corretta; la natura è bellissima e, se si scopre un meccanismo nuovo, è bellissimo comunicarlo, anche indipendentemente dalle applicazioni.
L’Italia ha una tradizione più umanistica che scientifica; è pertanto importante parlare al pubblico e ai giovani perché altrimenti la scienza rimane estranea, fa paura, non la si capisce e si temono, esagerandole, conseguenze pericolose. Credo che sia un cammino lungo e non facile.
Da un lato, spesso ai giornalisti la ricerca interessa quando c’è una cura o si può fare uno scoop. Al contrario, e soprattutto per i giovani, la ricerca è già bella come scoperta della natura e non necessariamente e solo perché risolve una malattia o migliora le nostre condizioni di vita. Inoltre, e soprattutto per la ricerca biomedica, quando si comunica bisogna avere un rispetto molto grande per il malato; l’informazione scientifica va data anche per raccontare quanto sia lungo e quanti controlli richieda il passaggio dai primi risultati sperimentali alla elaborazione di una terapia.
Questo è difficile da accettare per chi ha una malattia importante e va quindi spiegato con cura per non dare false speranze e per far condividere da tutti i problemi che stanno sotto un percorso di ricerca.
Quali passi sono necessari nel campo della formazione (universitaria o della scuola superiore) per creare studiosi disponibili a percorrere tutte le strade che un’indagine può aprire e/o ad accogliere la vasta gamma di ricadute e di possibilità applicative che una scoperta può suscitare?
Un’ottima formazione è quella che permette al ricercatore di essere esposto a tutti i diversi approcci e di capire il linguaggio dell’altro. Per esempio, nel nostro Istituto non ci si dedica solo agli aspetti tecnici della ricerca, ma si tengono anche seminari sul trasferimento tecnologico, sugli studi clinici, sulla elaborazione di un brevetto.
In sintesi, anche se il ricercatore non fa lui personalmente lo studio clinico, però deve essere in grado di parlare con il clinico e di combinare i dati che derivano da approcci diversi. I giovani che lavorano nel nostro Istituto possono entrare per fare la tesi di laurea e poi per fare il dottorato o il post-dottorato; in generale invitiamo i giovani, appena si sono fatti una preparazione adeguata, ad andare all’estero per completarla.
Contemporaneamente però accettiamo e invitiamo a lavorare da noi molti studenti stranieri. I corsi di dottorato sono diversi e possono formare non solo sulla ricerca di base, ma anche sulla bioetica, sulla ricerca clinica e sul traferimento tecnologico.
Ancora una parola sulla libertà della ricerca di base e sul rapporto con i finanziamenti?
Soprattutto a livello italiano (Fondazioni, Ministero della Salute) la maggior parte dei finanziamenti nazionali e in parte anche quelli internazionali richiedono che la ricerca sia finalizzata (per esempio ho scoperto la VE-caderina e produco un nuovo farmaco) mentre sono pochissimi i soldi investiti nello scoprire cose nuove e questo a mio parere è un vero e proprio suicidio perché se si finanzia solo la ricerca applicativa si fa una ricerca vecchia, perché si raffina qualcosa che già esiste.
La storia della scienza dimostra che il ricercatore deve poter usare la propria curiosità e il proprio ingegno, lavorando però con molto rigore e metodo. La maggior parte delle scoperte che hanno cambiato la nostra maniera di vivere deriva da ricerche fatte in totale libertà, non costrette su binari preordinati. La dote migliore del ricercatore è, come diceva il premio Nobel Barbara McClintock, quella di avere gli occhi per vedere «quello che gli altri non vedono».
Molti paesi hanno capito che proprio nei momenti di crisi come quello attuale bisogna investire in ricerca se si vuole domani essere competitivi sul mercato. Solo se saremo stati capaci di avanzare tecnologicamente potremo vendere prodotti di qualità e innovazione.
Così, proprio in questi giorni, Germania, Svezia, Francia hanno aumentato il budget assegnato alla ricerca.
L’Italia invece taglia ogni anno di più, ogni volta che occorrono soldi per altre cose questi si recuperano tagliando i fondi per la ricerca e questo, nel futuro, ci penalizzerà fortemente perché non saremo capaci di tenere la concorrenza e diventeremo completamente dipendenti dall’estero.
Vai all’articolo in formato PDF
A cura di Maria Cristina Speciani
(Caporedattore della Rivista Emmeciquadro)
Elisabetta Dejana
Ordinario di Patologia Generale presso il Dipartimento di Scienze Biomolecolari e Biotecnologie dell’Università degli Studi di Milano, responsabile del programma di Angiogenesi presso la Fondazione IFOM (Istituto FIRC di Oncologia Molecolare).
© Pubblicato sul n° 34 di Emmeciquadro
