La recente dipartita di Rita Levi-Montalcini ha riportato alla ribalta dei media la sua statura umana e scientifica. Questo contributo offre spunti di riflessione sul significato della sua scoperta (avvenuta quasi sessant’anni fa) in relazione agli sviluppi che si ebbero negli anni a seguire nell’ambito delle neuroscienze, in particolare per lo studio dei meccanismi biochimici per l’apprendimento e la memoria e per i disturbi del comportamento.
All’inizio degli anni Cinquanta del secolo scorso, il gruppo di ricercatori coordinato da Rita Levi-Montalcini (1909-2012) identificò una molecola che successivamente risultò avere un ruolo fondamentale nella differenziazione e funzionalità di due stipiti di cellule nervose: le cellule sensitive e simpatiche.
Fu una scoperta fortuita che non venne da ricerche in ambito neurologico; infatti i ricercatori osservarono che cellule tumorali (sarcoma) di topo trapiantate in un embrione di pollo producevano un fattore diffusibile che stimolava la crescita di cellule nervose sensoriali e simpatiche. La scoperta e la successiva caratterizzazione di questa nuova molecola, chiamata Fattore di Crescita Neuronale (Nerve Growth Factor, NGF), fu alla base dell’attribuzione alla Montalcini del premio Nobel per la Medicina nel 1986.
La scoperta di NGF e delle sue pleiomorfe attività stimolò la ricerca nell’ambito delle neuroscienze che portò negli anni alla individuazione e caratterizzazione di altre molecole strutturalmente e funzionalmente ad esso correlate: nel 1982 fu isolato dal cervello di maiale un fattore proteico, altamente omologo nella sequenza a NGF, che e` stato denominato fattore neurotrofico derivato dal cervello (Brain-Derive Neurotrophic Factor, BDNF); a seguire sono stati identificati gli altri componenti della famiglia delle neurotrofine (NTs) che, per quanto riguarda i mammiferi, comprende fino ad ora la neurotrofina 3 (NT-3) e la neurotrofina 4/5 (NT-4/5), i loro recettori cellulari altamenti specifici TrkA, TrkB e TrkC, e p75NTR.
La famiglia delle neurotrofine è dunque costituita da proteine secrete e strutturalmente molto simili, che hanno un ruolo importante nella regolazione della sopravvivenza (apoptosi), della differenziazione e del funzionamento di differenti popolazioni neuronali a livello del sistema nervoso sia centrale che periferico. Le neurotrofine svolgono la loro attività legandosi agli specifici recettori cellulari, la cui variabile espressione e localizzazione cellulare permette ad esse di indurre attività differenti su differenti tipi di neuroni e in differenti tessuti.  [A sinistra: Rita Levi-Montalcini riceve il Premio Nobel per la Medicina nel 1986]
[A sinistra: Rita Levi-Montalcini riceve il Premio Nobel per la Medicina nel 1986]
Le ricerche degli ultimi venti anni hanno portato robuste evidenze che NTs regolano, sia nel cervello in via di sviluppo che in quello maturo, quasi tutti gli aspetti dello sviluppo e della attività funzionale dei neuroni: proliferazione, differenziazione, crescita assonale e dendritica, formazione delle sinapsi, regolazione della loro attività e plasticità.
Il sistema nervoso centrale (SNC) è composto dal cervello e dal midollo spinale. La sua funzione è quella di recepire, integrare e coordinare le informazioni sensoriali provenienti sia dall’ambiente esterno che dall’interno del corpo e di elaborare e trasmettere le risposte sensitivo-motorie attivanti o inibenti l’attività di specifici organi come i muscoli o le ghiandole. SNC è anche la sede delle funzioni cognitive superiori come l’intelligenza, la memoria, l’apprendimento, le emozioni, eccetera.
Struttura del neurone
Il neurone è composto da un corpo cellulare (soma), da dendriti e da un assone. Il soma contiene il nucleo, il citoplasma e gli organuli intracitoplasmatici; i dendriti sono lunghi e sottili processi arboriformi che si dipartono dal corpo del neurone; l’assone è un lungo prolungamento del corpo cellulare in grado di propagare l’impulso elettrico.
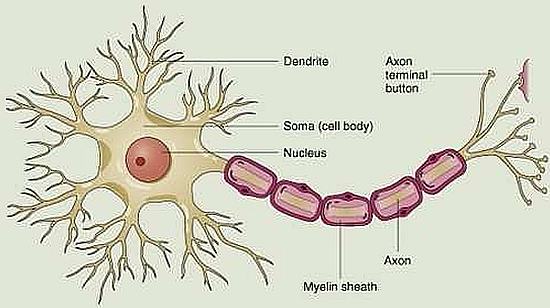 Struttura del Neurone
Struttura del Neurone
Ogni assone è in grado di stabilire un contatto con altri neuroni dando origine alla sinapsi.
La sinapsi (dal greco σύν – con e άπτειν – toccare, vale a dire connettere) è una struttura altamente specializzata che consente la comunicazione tra i neuroni stessi e di questi con altre cellule (muscolari, sensoriali, ghiandole).
Attraverso la trasmissione sinaptica, l’impulso nervoso può quindi viaggiare da un neurone all’altro e da un neurone a una fibra per esempio una fibra muscolare. Esistono due tipi di sinapsi: le sinapsi elettriche e le sinapsi chimiche.
La sinapsi elettrica consente la connessione tra le cellule per il passaggio diretto di impulsi elettrici da una cellula all’altra. Le sinapsi elettriche sono preferibilmente utilizzate per i riflessi per i quali è necessaria una rapida trasmissione delle informazioni.
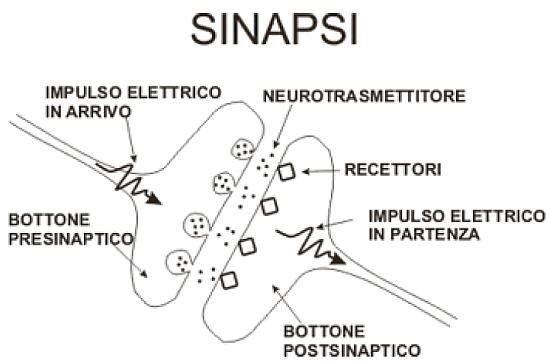 Sinapsi
Sinapsi
La sinapsi chimica è formata da tre elementi: il terminale presinaptico, lo spazio sinaptico e la membrana postsinaptica. Il terminale presinaptico è un’area specializzata dell’assone che contiene, racchiusi in piccole vescicole, i neurotrasmettitori. Le vescicole sinaptiche per l’effetto di particolari stimoli si fondono con la membrana, rilasciando il neurotrasmettitore nello spazio sinaptico. Qui il neurotrasmettitore entra in contatto con la membrana postsinaptica ove sono presenti i recettori o canali ionici. Il neurotrasmettitore in eccesso viene riassorbito nella membrana presinaptica stessa o degradato e inattivato da specifici inibitori sinaptici.
Plasticità neuronale
Con il termine plasticità si intende comunemente la capacità di una sostanza di subire significative deformazioni di forma e ampiezza che possono essere mantenute nel tempo. Questo termine, che ha trovato ampio utilizzo per descrivere le proprietà meccaniche di alcuni materiali, solo recentemente ha trovato applicazioni in campo biologico per descrivere la modificabilità di alcuni tessuti, incluso il cervello, per effetto della esposizione all’ambiente. Per plasticità sinaptica si intende quindi il meccanismo per il quale l’animale adulto, ma anche quello in via di sviluppo, «impara» dall’ambiente, cioè si adatta ad esso.
Nel 1780 Vincenzo Malacarne (1744-1816) già poneva le basi per quella che sarà la futura teoria della plasticità neuronale. Egli osservò infatti che in coppie di animali gemelli, maggiore era lo sviluppo del cervello del gemello sottoposto a particolari stimoli ambientali. Analogamente Charles Darwin (1809-1882) osservando che il cervello degli animali domestici era meno sviluppato di quello degli omologhi selvatici, ipotizzava che gli animali domestici non avessero per molte generazioni avuto la necessità di esercitare il cervello e i sensi per adattarsi alle necessità ambientali.
Fu solo alla fine del XIX secolo che il termine plasticità neuronale cominciò a essere utilizzato nelle comunicazioni scientifiche con non poche obiezioni. In quel tempo nel campo delle neuroscienze due erano le principali ipotesi: la «teoria reticolare» dell’italiano Camillo Golgi (1843-1926) e la «teoria nel neurone» dello spagnolo Santiago R. Cajal (1853-1934).
 [A sinistra: Camillo Golgi durante una passeggiata sulla mulattiera che collega Corteno, suo luogo di nascita, all’Aprica]
[A sinistra: Camillo Golgi durante una passeggiata sulla mulattiera che collega Corteno, suo luogo di nascita, all’Aprica]
Golgi ipotizzava il sistema nervoso come un insieme ininterrotto di tutti i suoi componenti, mentre Cajal sosteneva che i neuroni, separati gli uni dagli altri, potessero comunicare con quelli attigui mediante aree altamente specializzate chiamate sinapsi.
Nel 1906 il medico psichiatra Ernesto Lugaro (1870-1940) per la prima volta utilizzò il termine plasticità facendo riferimento non solo a possibili modificazioni morfologiche ma anche a possibile comunicazione inter-neuronale mediante «processi chimici» a livello delle sinapsi.
La maggior parte dei ricercatori indica nel neurofisiologo polacco Jerzy Konorski (1903-1973) il padre della moderna teoria della «plasticità neuronale», indicandola come proprietà fondamentale del sistema nervoso centrale degli animali superiori, e quindi dell’uomo, e che potrebbe costituire il meccanismo per i processi di apprendimento, della memoria e del recupero funzionale dopo lesioni del cervello.
Le funzioni legate al fenomeno della memoria sono state localizzate nell’ippocampo e nelle strutture limbiche ad esso associate.
Si distinguono una memoria a «breve termine», che dura da alcuni secondi a pochi minuti, e una memoria a «lungo termine» che permane per ore e più, per la quale è necessaria la sintesi di specifiche proteine tra le quali fondamentale è il ruolo del BDNF. Gravi ritardi nell’apprendimento e nella memoria spaziale sono stati infatti dimostrati in animali nei quali, con tecniche di manipolazione genica o farmacologicamente, era stata inibita l’espressione di BDNF o del suo recettore TrkB.
Per le loro importanti attività a livello del controllo dello sviluppo neuronale e dell’attività sinaptica NTs sono attualmente oggetto di studi nell’ambito delle neuroscienze, finalizzati a meglio comprendere il loro ruolo nei meccanismi fisiologici regolativi, ma anche il loro possibile coinvolgimento nella patogenesi di malattie che colpiscono il sistema nervoso centrale caratterizzate dalla morte di specifiche popolazioni neuronali quali la Malattia di Alzheimer e il Morbo di Parkinson, e più recentemente anche malattie psichiatriche come la Depressione, l’obesità severa e più in generale i disturbi dell’appetito, e nei meccanismi di controllo della genesi del dolore.
Neurotrofine e Depressione
La Depressione è un disturbo psichiatrico con rilevanti ricadute sulla qualità della vita di un ampio numero di soggetti. Cambiamenti nell’omeostasi delle neurotrofine si ritiene possano essere alla base dell’insorgenza del quadro depressivo.
Lo stress è uno dei fattori scatenanti la Depressione e, anche se non completamente confermati, molti studi hanno dimostrato un’associazione tra lo stress e i livelli di neurotrofine. Condizioni di stress protratto causano atrofia e morte dei neuroni nell’ippocampo e una riduzione del volume dello stesso è stata osservata in soggetti sottoposti a stress prolungato e in soggetti depressi.
In altre ricerche, a supporto del coinvolgimento delle neurotrofine nella Depressione, è stato dimostrato come la somministrazione di farmaci antidepressivi si associa a incremento della produzione di BDNF e NGF nell’ippocampo e nella corteccia, le aree del cervello maggiormente implicate nei fenomeni chimici alla base della Depressione.
In sintesi, la dimostrazione che la produzione di neurotrofine, e in particolare di BDNF, si riduce in presenza di Depressione, mentre gli antidepressivi, che riducono le manifestazione cliniche di questa malattia, aumentato la sintesi di neurotrofine sostengono la stretta correlazione tra omeostasi neurotrofinica e disordini psichiatrici, aprendo la strada agli studi per un possibile uso di BDNF in campo terapeutico.
Neurotrofine e Dolore fisico
Il dolore deriva dalla «spiacevole» rielaborazione a livello del sistema nervoso centrale di una stimolo generatosi in periferia: il dolore dipende quindi dalla cooperazione del sistema nervoso centrale e periferico.
Il possibile coinvolgimento delle neurotrofine, viene da molteplici osservazioni: in pazienti affetti da una rara malattia ereditaria (Insensibilità congenita della percezione del dolore con anidrosi), legata alla scorretta percezione del dolore, ci sono mutazioni nel gene di TrkA, uno dei principali recettori per NGF e BDNF; elevati livelli di neurotrofine sono trovati nelle urine di donne affette da cistite; farmaci che inducono infiammazione vescicale comportano alterazione nei riflessi della minzione. In modelli animali per lo studio dei meccanismi associati alla nocicezione si è dimostrato che l’induzione della sintesi di NGF comporta iperalgesia sia agli stimoli meccanici che termici, e topi transgenici che iper-esprimono NGF soffrono di iperalgesia, al contrario quelli che iper-esprimono NGF-inattivo sono indifferenti agli stessi stimoli.
La recente dimostrazione che il sequestro di NGF, per esempio con la somministrazione di anticorpi monoclonali anti-NGF, si associa a un drastico innalzamento della soglia dolorifica suggerisce un possibile utilizzo clinico di molecole inibenti, sequestranti o degradanti NGF.
Neurotrofine e Infiammazione
NGF si ritiene sia un potente modulatore dell’attività di molte cellule immunocompetenti. Stimola la proliferazione, la differenziazione e sopravvivenza di linfociti, eosinofili, monociti e neutrofili; stimola la degranulazione dei mastociti, dei macrofagi, dei basofili e degli eosinofili.
La somministrazione per via inalatoria di NGF o BDNF aumenta l’iperreattività bronchiale con un meccanismo che coinvolge il controllo neurogenico delle fibre muscolari peribronchiali. Le neurotrofine sembrano quindi coinvolte anche nei meccanismi alla base della risposta infiammatoria acuta e cronica, e nel controllo delle manifestazioni locali a essa associate.
Neurotrofine e Malattia di Alzheimer
La Malattia di Alzheimer, la più comune forma di demenza nella popolazione adulta, è la quarta causa di morte nei paesi industrializzati, e sta diventando un serio problema socio-sanitario anche nei paesi in via di sviluppo come diretta conseguenza dell’aumento della durata della vita.
I sintomi della malattia comprendono: disturbi neuropsicologici (afasia, aprassia, agnosia, amnesia); disturbi comportamentali; disabilità. Dal punto di vista neuropatologico la malattia si caratterizza per la progressiva perdita di neuroni in specifiche aree cerebrale, la deposizione extracellulare di amiloide (placche) e intracellulare di proteina tau-iperfosforilata (grovigli neuro-fibrillari).
La conseguenza di queste modificazioni cerebrali sono l’impossibilità per il neurone di trasmettere gli impulsi nervosi, e la sua morte, con conseguente atrofia progressiva del cervello nel suo complesso. La malattia si caratterizza anche per una notevole diminuzione in specifiche aree cerebrali dei livelli del neurotrasmettitore acetilcolina.
Allo stato attuale delle ricerche non è dato proporre uno specifico coinvolgimento di NTs nella patogenesi della Malattia di Alzheimer; tuttavia i risultati degli studi sull’animale che dimostrano come la somministrazione di NGF ristabilisca l’attività colinergica e riduca il numero della placche amiloidee, fa ipotizzare che in fase preclinica, la modulazione farmacologica del net-work neurotrofinico potrebbe essere utile per rallentare la progressione della malattia.
Conclusione
In conclusione, dalla casuale scoperta delle neurotrofine molta strada è stata fatta dalla ricerca in campo biologico e psicocomportamentale. È ormai accertato che queste molecole giocano un ruolo rilevante sia nei processi per la maturazione di molte cellule che per la loro sopravvivenza e attività funzionale.
Cambiamenti nell’espressione delle neurotrofine e/o dei loro recettori sembrano essere implicati nella patofisiologia di alcune malattie organiche e nei disturbi dell’umore.
Non è quindi azzardato pensare che in un prossimo futuro vengano prodotti antagonisti neurotrofinici (molecole mimetiche, anticorpi monoclonale, inibitori enzimatici, eccetera) che potrebbero essere utili per il controllo dell’infiammazione, del dolore, di alcuni disturbi psicocomportamentali e di malattie neurodegenerative con un approccio di ordine eziologico e non sintomatologico.
Luigi Bergamaschini
(Professore associato in Medicina Interna presso l’Università degli Studi di Milano)
Indicazioni bibliografiche
Nerve growth factor isolated from sarcoma 37 and 180, Cohen S., Levi Montalcini R., Hamburger V.A., Proc Natl Acad Sci USA 1954; 40:1014-1018
The nerve growth factor and the neuroscience chess board, Levi-Montalcini R., Arch Ital Biol. 2003 Mar;141(2-3):85-8
Nerve growth factor: from the early discoveries to the potential clinical use, Aloe L., Rocco M.L., Bianchi P., Manni L., J Transl Med. 2012 Nov 29;10:239
Neurotrophin regulation of neural circuit development and function, Park H., Poo M.M., Nat Rev Neurosci. January 2013 ;14(1):7-23
Nerve growth factor: from the early discoveries to the potential clinical use, Aloe L., Rocco M.L, Bianchi P., Manni L., J Transl Med. 2012 Nov 29;10:239
Nerve growth factor as a signaling molecule for nerve cells and also for the neuroendocrine-immune systems, Fiore M., Chaldakov G.N., Aloe L., Rev Neurosci. 2009;20(2):133-45. Review
Clinical relevance of the neurotrophins and their receptors, Allen S.J., Dawbarn D., Clin Sci (Lond). 2006 Feb;110(2):175-91. Review
NGF receptor TrkAd5: therapeutic agent and drug design target, Dawbarn D., Fahey M., Watson J., Tyler S., Shoemark D., Sessions R., Zhang R., Brady L., Willis C., Allen S.J., Biochem Soc Trans. 2006 Aug;34(Pt 4):587-90.
© Pubblicato sul n° 48 di Emmeciquadro
