 “for their discoveries of machinery regulating vesicle traffic, a major transport system in our cells”
“for their discoveries of machinery regulating vesicle traffic, a major transport system in our cells”
Per il corrente anno 2013 tre scienziati hanno condiviso il premio Nobel per la fisiologia o la medicina. Si tratta degli americani James E. Rothman e Randy W. Schekman (rispettivamente all’Università della California a Berkeley e all’Università di Yale), e del tedesco naturalizzato americano Thomas C. Südhof (alla Stanford University, California).
Sebbene questi scienziati abbiano condotto studi indipendenti, ciò che li accomuna è che tutti si sono occupati di un fenomeno di primaria importanza nella biologia cellulare, che va sotto il nome di traffico vescicolare.
Per comprendere la natura di questo fenomeno, come pure la sua centralità nell’economia delle cellule e le implicazioni nel campo della medicina, è necessario premettere alcune caratteristiche delle cellule degli organismi più complessi, in pratica tutti quelli pluricellulari (ma anche molti unicellulari). Tali cellule sono dette eucariotiche e ciò che le contraddistingue è una sofisticata compartimentazione al loro interno; in altre parole, esse presentano organuli confinati da membrane, il più noto dei quali è certamente il nucleo dove è immagazzinato il materiale genetico. Esistono però altri compartimenti, che si fanno carico dello smistamento di molecole dal luogo della loro sintesi alla loro destinazione finale, che può essere all’interno o anche all’esterno della cellula. Per lo più tali molecole sono proteine, ma non solo, come sarà illustrato più oltre. Per quanto riguarda le proteine, esse sono sintetizzate nel citosol, vale a dire nel fluido intracellulare che contiene gli organuli.
Tuttavia non tutte le proteine stazionano permanentemente nel citosol, in quanto la loro presenza è richiesta in altre localizzazioni intracellullari o anche al di fuori della cellula. Il sistema primariamente destinato allo smistamento delle proteine consiste del reticolo endoplasmatico e dell’apparato del Golgi.
Come mostrato nell’immagine che segue, il reticolo endoplasmatico è un intricato sistema di cisterne dove, già durante la loro sintesi, sono traslocate le proteine destinate a essere smistate ad altri comparti intracellulari come pure ad essere secrete, cioè rilasciate nello spazio extracellulare. Qui esse vanno incontro a complesse modificazioni chimiche (principalmente l’aggiunta di zuccheri) che le rendono funzionali.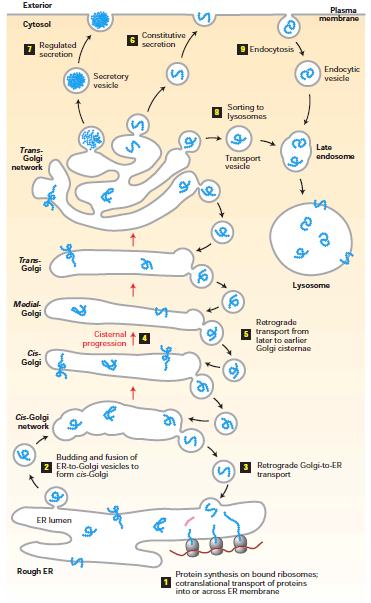 [A sinistra: Uno schema della via secretoria. Le proteine sono traslocate nel reticolo endoplasmatico (ER) già durante la sintesi. Vescicole rilasciate dall’ER raggiungono l’apparato di Golgi e qui possono essere destinate sia all’esocitosi con rilascio di molecole all’esterno, sia al lisosoma. Nello schema è rappresentata anche l’endocitosi, che porta alla internalizzazione di molecole e complessi di vario tipo]
[A sinistra: Uno schema della via secretoria. Le proteine sono traslocate nel reticolo endoplasmatico (ER) già durante la sintesi. Vescicole rilasciate dall’ER raggiungono l’apparato di Golgi e qui possono essere destinate sia all’esocitosi con rilascio di molecole all’esterno, sia al lisosoma. Nello schema è rappresentata anche l’endocitosi, che porta alla internalizzazione di molecole e complessi di vario tipo]
Il vero e proprio «centro di smistamento» è però l’apparato del Golgi, che consiste di un certo numero di cisterne impilate l’una sull’altra. Dunque, le proteine passano dal reticolo endoplasmatico all’apparato del Golgi, e da qui possono essere secrete all’esterno della cellula (in un processo denominato esocitosi), oppure destinate ai lisosomi, organuli che contengono una nutrita batteria di enzimi litici, destinati cioè a degradare molteplici componenti intra- ed extra-cellulari, incluse le proteine stesse. A completare il quadro del traffico vescicolare è essenziale menzionare l’endocitosi, un processo che consente di importare proteine dall’esterno in modo di norma molto selettivo.
Come indica la denominazione stessa del fenomeno descritto (traffico vescicolare), i suoi protagonisti sono le vescicole di trasporto. La traslocazione selettiva da reticolo endoplasmatico ad apparato del Golgi, e da quest’ultimo alla membrana cellulare o ai lisosomi, come pure i fenomeni di esocitosi ed endocitosi, possono infatti aver luogo grazie alla formazione di vescicole, minuscole sferule che gemmano dalle membrane della struttura di provenienza e si fondono con le membrane della struttura di destinazione. Le vescicole sono autentici sistemi di spedizione, in quanto all’atto della loro formazione vengono caricate di proteine o altre molecole e inviate a un «destinatario» ben preciso.
Per evidenziare l’enorme importanza di questi processi nella funzione delle cellule e degli organismi più complessi, basti pensare che l’esocitosi garantisce la secrezione controllata di ormoni di natura proteica, quali per esempio l’insulina, l’ormone della crescita, o di altre importantissime proteine quali gli anticorpi e l’albumina di siero.
L’endocitosi non è meno importante, in quanto garantisce l’apporto di composti essenziali per la costruzione di una cellula. È noto a tutti, per esempio, che esistono nel sangue assemblaggi di molecole (come le HDL e le LDL) adibiti al trasporto a tutte le cellule del colesterolo, un componente essenziale delle membrane.
Ebbene, tali assemblaggi vengono internalizzati mediante endocitosi, e le vescicole che si formano a seguito di tale processo sono indirizzate ai lisosomi, dove il contenuto vescicolare viene disassemblato e le singole componenti rese disponibili alla cellula. A loro volta, i lisosomi vengono approvvigionati degli enzimi litici necessari per il loro funzionamento grazie all’invio di vescicole che provengono dall’apparato del Golgi e che in modo rigorosamente selettivo si fondono con la membrana di questi organuli.
Le investigazioni dei tre protagonisti
Gli elementi forniti in questa breve descrizione già da soli rendono evidente la complessità e la straordinaria perfezione nel funzionamento di questo macchinario cellulare. Ciò che in particolare ha interrogato gli scienziati per decenni è come potesse una vescicola rilasciata dalla membrana di un determinato organulo raggiungere senza errori la destinazione prevista in un ambiente così complesso e sovraffollato come quello intracellulare, dove sono presenti decine di membrane di diverso tipo.  [A destra: James E. Rothman (1950 – …)]
[A destra: James E. Rothman (1950 – …)]
Questo è stato primariamente l’oggetto delle investigazioni di Rothman, il quale ha dimostrato l’esistenza di complessi proteici presenti su tutte le membrane, che consentono l’attracco delle membrane vescicolari a quelle «bersaglio», la loro conseguente fusione e il rilascio del contenuto vescicolare nel comparto racchiuso dalle membrane bersaglio.
Complessi proteici di questo tipo esistono in tutte le membrane e regolano non soltanto il traffico intracellulare, ma anche l’endocitosi e l’esocitosi. Essi si riconoscono reciprocamente e si legano in modo altamente specifico, secondo una modalità che ricorda l’associazione dei due lembi di una cerniera lampo durante la sua chiusura.
Sebbene tali complessi abbiano una struttura pressoché identica in tutte le membrane, sottili differenze tra un complesso e l’altro sono alla base della rigorosa selettività del riconoscimento.
 [A sinistra: Randy W. Schekman (1948 – …)]
[A sinistra: Randy W. Schekman (1948 – …)]
Schekman ha invece condotto studi che hanno consentito di stabilire con esattezza il tragitto che le proteine compiono dalla loro sintesi fino alla destinazione finale, che può essere, per citare i due esempi più prominenti, l’ambiente extracellulare nel caso dell’esocitosi, oppure il lisosoma nel caso degli enzimi litici.
Sebbene oggi le tappe di tale tragitto sembrino ovvie a tutti i ricercatori, la ricostruzione di tale sequenza è stata un’impresa scientifica di tutto rilievo.
Schekman ha risolto il problema utilizzando cellule di lievito come organismo modello per le sue investigazioni. Il lievito è un eucariote unicellulare, e in quanto tale è molto distante evolutivamente dall’uomo. Potrebbe pertanto apparire sorprendente che quanto osservato in tale organismo in merito al traffico vescicolare sia nella sostanza identico a quello che avviene nelle nostre cellule: tuttavia una mole inoppugnabile di evidenze ha confermato che è precisamente così. Il lievito offre in aggiunta il vantaggio di una semplicità molto maggiore nella manipolazione sperimentale rispetto alle cellule di mammifero.
Utilizzando specifici mutanti di lievito con difetti nella progressione delle proteine verso la secrezione, Schekman ha individuato punti di blocco in tale tragitto, potendo così riordinare le singole tappe nella loro precisa sequenza. È degno di nota che certe proteine identificate da Schekman nel lievito in quanto implicate in talune di queste tappe, corrispondono esattamente alle proteine di mammifero identificate da Rothman come responsabili dell’attracco delle vescicole alle membrane di destinazione.
Il contributo di Südhof rientra anch’esso nell’ambito delle problematiche legate al traffico vescicolare.  [A destra: Thomas C. Südhof (1955 – …)]
[A destra: Thomas C. Südhof (1955 – …)]
Tuttavia egli non si è occupato del ruolo delle vescicole nello smistamento delle proteine, bensì dei meccanismi con cui le vescicole trasportano i neurotrasmettitori, una classe di piccole molecole non-proteiche che hanno un ruolo centrale nella trasmissione dell’impulso nervoso tra i neuroni a livello delle sinapsi. Alle estremità degli assoni, prolungamenti dei neuroni che trasmettono l’impulso nervoso in direzione centrifuga, i neurotrasmettitori (quali per esempio l’acetilcolina, l’adrenalina, la serotonina) vengono «impacchettati» in vescicole di trasporto, che poi si fondono con la parte terminale della membrana dell’assone, rilasciando il loro contenuto nello spazio intersinaptico in un processo che è in tutto simile alla già descritta esocitosi delle proteine.
Nello spazio intersinaptico i neurotrasmettitori rilasciati stimolano il neurone successivo interagendo con specifici recettori sulla sua membrana. Südhof ha anche dimostrato che il rilascio dei neurotrasmettitori è innescato da un rientro di ioni calcio all’interno del neurone. Infine, una volta effettuato il rilascio, le vescicole rientrano nel citosol distaccandosi dalla membrana, e nel citosol sono rese disponibili per un nuovo carico di neurotrasmettitori.
Le scoperte qui descritte hanno diverse implicazioni nel campo della medicina. Esiste per esempio un repertorio di gravi patologie su base genetica dette malattie da accumulo lisosomiale, che portano a gravi deformità scheletriche e deficienze neurologiche, la cui causa può essere un difetto nel trasporto di enzimi al lisosoma.
La comprensione dei meccanismi molecolari della patologia, conseguita anche grazie agli studi di Rothman e Schekman, rappresenta il prerequisito per lo sviluppo di terapie impostate su base razionale. Inoltre molte altre patologie, come certe forme di diabete e una forma di emofilia, sono anch’esse legate a difetti nel sistema di secrezione. Per quanto riguarda gli studi di Südhof sui neurotrasmettitori, essi hanno posto le basi per lo sviluppo di psicofarmaci ad azione antidepressiva, in quanto questi interferiscono con il meccanismo di trasmissione sinaptica.
Infine il lavoro di Schekman sul lievito ha avuto anche ricadute nell’ambito delle biotecnologie, in quanto ha consentito di ingegnerizzare questo microorganismo così da portarlo a secernere per esocitosi grandi quantità di diverse proteine di interesse terapeutico, come per esempio l’insulina. Le proteine così rilasciate possono quindi essere facilmente purificate e utilizzate a scopo terapeutico, con procedure enormemente più semplici di quelle disponibili in precedenza.
Vai all’articolo in formato PDF
Paolo Tortora
(Ordinario di Biochimica, presso il Dipartimento di Biotecnologie e Bioscienze dell’Università degli Studi di Milano-Bicocca)
© Pubblicato sul n° 51 di Emmeciquadro
