L’articolo riprende la relazione tenuta dall’autore, chimico-fisico di fama internazionale, in occasione di un convegno organizzato dalla Fondazione Enrico Mattei.
L’autore descrive le «strane» proprietà dell’acqua liquida e mostra perché la rendono un mezzo unico e particolarmente efficace nel promuovere processi singolari, che possono avere profonda rilevanza sulle caratteristiche del mondo fisico.
Una carrellata di concetti chiave, ampiamente illustrata, per comprendere gli aspetti fondamentali – anche tecnici – dei tantissimi momenti della vita quotidiana in cui c’entra l’acqua. Ma in questo campo l’indagine è ancora aperta, soprattutto per quanto riguarda la modellizzazione a livello molecolare e alle dimensioni della nanoscala.
Così da poter dire, con il biofisico Felix Franks che «di tutti i liquidi conosciuti l’acqua è probabilmente quello più studiato e meno compreso».
La struttura chimica dell’acqua è semplice: si tratta di una molecola costituita da un atomo di ossigeno (in rosso nell’immagine a destra) legato a due atomi di idrogeno (bianco).  Tuttavia il suo comportamento fisico e chimico presenta aspetti peculiari che hanno alimentato stravaganti fantasie.
Tuttavia il suo comportamento fisico e chimico presenta aspetti peculiari che hanno alimentato stravaganti fantasie.  Nel decennio che ha avuto inizio negli anni Sessanta dello scorso secolo il mondo della scienza è stato scosso da un dibattito incentrato sulla possibilità che l’acqua si trasformasse in un polimero solido, chiamato «poliacqua» (nell’immagine a lato), con conseguenze funeste per tutti gli organismi viventi, inclusi gli uomini. Tale prospettiva si è rivelata fortunatamente priva di senso.
Nel decennio che ha avuto inizio negli anni Sessanta dello scorso secolo il mondo della scienza è stato scosso da un dibattito incentrato sulla possibilità che l’acqua si trasformasse in un polimero solido, chiamato «poliacqua» (nell’immagine a lato), con conseguenze funeste per tutti gli organismi viventi, inclusi gli uomini. Tale prospettiva si è rivelata fortunatamente priva di senso.
Negli anni Ottanta affiorò invece l’opinione che l’acqua fosse in grado di conservare la memoria di molecole da essa allontanate offrendo un gratificante supporto alla medicina omeopatica. Ma anche questa caratteristica non venne confermata.
In realtà, il fatto che l’acqua sia un liquido atipico è assodato da fatti oggettivi che riguardano diverse sue proprietà.
Le proprietà dell’acqua
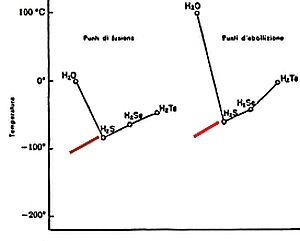 I valori delle temperature di fusione ed ebollizione dei composti con l’idrogeno degli elementi del sesto gruppo del sistema periodico in corrispondenza dell’acqua risultano molto più elevati di quanto si potrebbe prevedere sulla base di una semplice estrapolazione.
I valori delle temperature di fusione ed ebollizione dei composti con l’idrogeno degli elementi del sesto gruppo del sistema periodico in corrispondenza dell’acqua risultano molto più elevati di quanto si potrebbe prevedere sulla base di una semplice estrapolazione.
Data l’importanza che l’acqua liquida riveste per i fenomeni vitali, che si svolgono in un intervallo di temperatura nell’intorno di 20 °C, tale anomalia risulta essenziale per la nostra esistenza.
Un altro dato importante riguarda la densità dell’acqua liquida che è superiore a quella del solido.  Per questo motivo il ghiaccio galleggia sul liquido, come si verifica nel caso degli iceberg, di cui solo il 10% della massa è al di sopra della superficie.
Per questo motivo il ghiaccio galleggia sul liquido, come si verifica nel caso degli iceberg, di cui solo il 10% della massa è al di sopra della superficie. 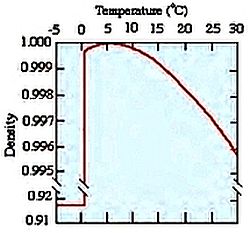 Infatti il congelamento dei laghi inizia dalla superficie e procede verso il fondo permettendo la sopravvivenza della vita lacustre anche a basse temperature.
Infatti il congelamento dei laghi inizia dalla superficie e procede verso il fondo permettendo la sopravvivenza della vita lacustre anche a basse temperature.
Indizi sul comportamento dell’acqua ci vengono offerti dalle cosiddette «funzioni responso», che costituiscono una misura della risposta fornita da un materiale sottoposto ad una sollecitazione esterna, quale il riscaldamento o la compressione.
Come si vede nell’immagine che segue, il calore specifico (a pressione costante Cp), che esprime il rapporto fra l’energia termica accumulata da una sostanza e la corrispondente variazione di temperatura, per l’acqua (linea azzurra) risulta più elevato di quello di liquidi analoghi, come gli alcoli (linea arancione).
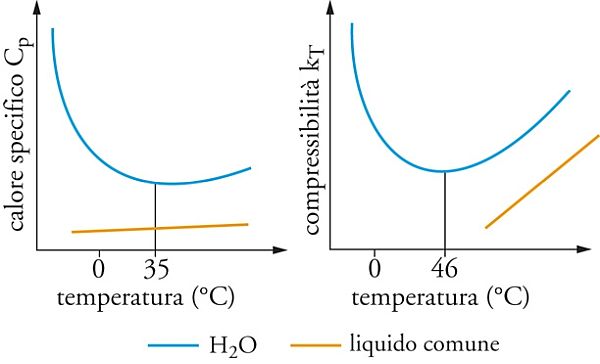
Anche la risposta dell’acqua a una variazione di pressione è atipica, poiché si distingue dagli altri liquidi per i valori nettamente più alti della sua compressibilità.
L’elevato valore del calore specifico dell’acqua liquida si riflette nella sua capacità di accumulare energia termica. Grazie a questa proprietà le correnti oceaniche calde (come la corrente del Golfo) sono in grado di scambiare con l’atmosfera elevate quantità di calore che contribuiscono a mantenere nel pianeta un clima temperato.
Ritratto (termodinamico) dell’acqua

 Nel 1876 Willard Gibbs (a sinistra, Josiah Willard Gibbs, 1839-1903) volse l’attenzione sulle «vite private dei sistemi» ponendo l’accento sul ruolo esercitato dall’entropia S, unitamente all’energia interna U e al volume V per individuare lo stato di un sistema.
Nel 1876 Willard Gibbs (a sinistra, Josiah Willard Gibbs, 1839-1903) volse l’attenzione sulle «vite private dei sistemi» ponendo l’accento sul ruolo esercitato dall’entropia S, unitamente all’energia interna U e al volume V per individuare lo stato di un sistema. 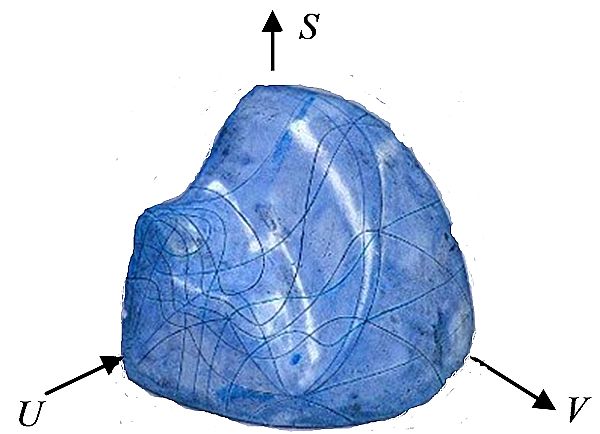 Per l’acqua la superfice che rappresenta la relazione esistente fra tali grandezze si può rappresentare con un plastico, come quello costruito sulla base di uno schizzo originale di James Maxwell (sopra a destra, James Clerk Maxwell, 1831-1879) rappresentato nella figura qui a lato.
Per l’acqua la superfice che rappresenta la relazione esistente fra tali grandezze si può rappresentare con un plastico, come quello costruito sulla base di uno schizzo originale di James Maxwell (sopra a destra, James Clerk Maxwell, 1831-1879) rappresentato nella figura qui a lato.
In realtà importanza si deve attribuire alla funzione energia libera, espressa da F=U-TS, per la quale è valida la seguente relazione:
![]()
Essendo P la pressione.
Viene chiamata equazione di stato poiché descrive il legame fra tre variabili che caratterizzano i diversi stati di aggregazione o fasi di un determinato componente, ovvero la temperatura T, il volume V e la pressione P. 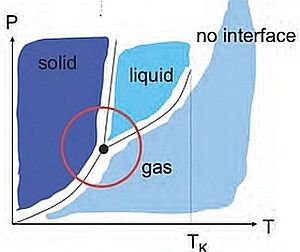 La situazione risultante viene rappresentata nel grafico a lato, poiché ogni punto della superficie rappresentata riflette il legame tra le variabili di stato e caratterizza lo stato del sistema individuando se si tratta di un solido, un liquido, un vapore.
La situazione risultante viene rappresentata nel grafico a lato, poiché ogni punto della superficie rappresentata riflette il legame tra le variabili di stato e caratterizza lo stato del sistema individuando se si tratta di un solido, un liquido, un vapore.
La descrizione di tale superficie di stato mediante una relazione matematica, che includa sia la fase liquida che quella gassosa, dal punto di vista teorico fondamentale costituisce un problema di notevole difficoltà. 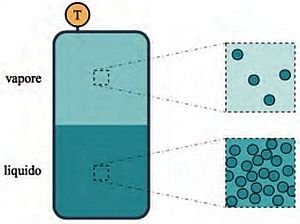 Infatti occorre far riferimento a modelli molecolari che tengano conto sia della disposizione delle molecole nello spazio, sia delle loro interazioni reciproche. Fra i diversi stati della materia quello liquido è il più difficile da studiare perché le molecole sono molto addensate e quindi a contatto reciproco, e sono distribuite disordinatamente nello spazio.
Infatti occorre far riferimento a modelli molecolari che tengano conto sia della disposizione delle molecole nello spazio, sia delle loro interazioni reciproche. Fra i diversi stati della materia quello liquido è il più difficile da studiare perché le molecole sono molto addensate e quindi a contatto reciproco, e sono distribuite disordinatamente nello spazio.
La termodinamica molecolare è volta a esprimere il comportamento dei fluidi dalla conoscenza delle interazioni fra le molecole. L’equazione di stato viene ricavata con l’equazione precedente dall’energia libera del sistema, che viene espressa mediante un complesso integrale detto “delle configurazioni”, che derivato rispetto al volume, a temperatura costante, risulta uguale alla pressione del sistema.
Purtroppo “Hic sunt leones!” non si può fare a meno di osservare poiché tale calcolo può essere condotto in modo relativamente facile per gas rarefatti dove le molecole sono lontane e interagiscono solo a coppie, ma nel caso dei liquidi dove le molecole sono a stretto contatto risulta tetragono alle più agguerrite tecniche matematiche. Mettendo così in dubbio la nostra capacità di capire la natura dello stato liquido e quella di giustificare l’esistenza di una temperatura critica al di sopra della quale non esiste materia condensata, in particolare liquida.
Fino alla metà del secolo scorso si riteneva che la soluzione di questo problema non fosse perseguibile prima di una cinquantina di anni. Se nell’Ottocento era stato compreso lo stato gassoso e nel Novecento quello solido, la comprensione dello stato liquido sarebbe avvenuta solo nel XXI secolo. 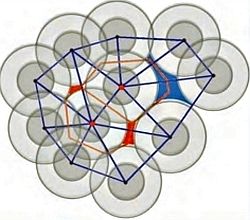 Tuttavia, nella seconda metà del Novecento, si è realizzato un «punto di svolta» con l’impiego di metodi detti «perturbativi», in cui, come evidenziato nell’immagine a lato, si assume che la struttura di un liquido (ovvero la distribuzione delle molecole nello spazio) sia determinata dalla parte repulsiva (dura) del potenziale intermolecolare, mentre la parte attrattiva (soffice) determina il valore dell’energia.
Tuttavia, nella seconda metà del Novecento, si è realizzato un «punto di svolta» con l’impiego di metodi detti «perturbativi», in cui, come evidenziato nell’immagine a lato, si assume che la struttura di un liquido (ovvero la distribuzione delle molecole nello spazio) sia determinata dalla parte repulsiva (dura) del potenziale intermolecolare, mentre la parte attrattiva (soffice) determina il valore dell’energia. 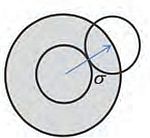 In realtà la scelta di un sistema di riferimento per valutare le proprietà di un generico fluido corrisponde al modello formulato nel 1873 dallo scienziato olandese Johannes Diderik van der Waals (1837-1923), in cui le molecole sono assimilate a sfere dure soggette a deboli forze attrattive che, nell’insieme, danno origine a un campo medio di energia potenziale.
In realtà la scelta di un sistema di riferimento per valutare le proprietà di un generico fluido corrisponde al modello formulato nel 1873 dallo scienziato olandese Johannes Diderik van der Waals (1837-1923), in cui le molecole sono assimilate a sfere dure soggette a deboli forze attrattive che, nell’insieme, danno origine a un campo medio di energia potenziale.
I risultati sembravano indicare che, anche per lo stato liquido, l’approccio molecolare si integra con il comportamento termodinamico macroscopico. In particolare giustifica la presenza di uno stato critico oltre il quale non si distingue il liquido dal vapore. I calcoli sono stati estesi a molecole con forme complesse riconducibili a corpi duri (dischi, cilindri, sigari…) e risulta efficace per diverse sostanze, pure e in miscela.
Purtroppo per l’acqua fornisce risultati in mediocre accordo con quelli sperimentali anche se la sua molecola appare semplice, e assimilabile a una sfera. Perché?
Fatti e previsioni
Diceva Sherlock Holmes: «è difficile formulare teorie, e quindi fare previsioni, se non si conoscono i fatti».
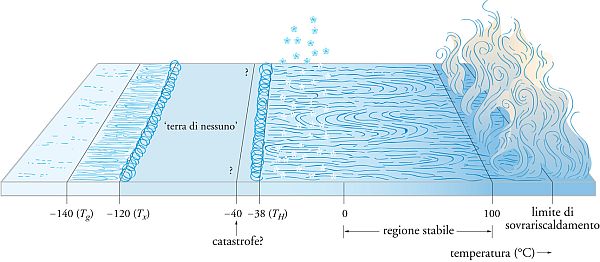
Il comportamento anomalo dell’acqua si può descrivere osservando il diagramma nell’immagine qui sopra riportata. Essa si riferisce alla pressione di 1 atm e mostra come, al diminuire della temperatura, appaiono diverse fasi condensate, liquide e solide, in particolare alcune fasi liquide si trovano a temperature inferiori a quelle di formazione del ghiaccio.
Infatti, al di sotto di Tg= -140 °C = 133 K, il ghiaccio è presente in una forma amorfa, o vetrosa, che, riscaldata, fornisce un liquido ultraviscoso; se portato a una temperatura superiore a -120 °C, tale liquido forma il comune ghiaccio cristallino.
La zona compresa fra Tx = -120 °C = 153 K e TH = -38 °C = 235 K viene chiamata «terra di nessuno» perché difficilmente esplorabile sperimentalmente.
La terra di nessuno contiene ghiaccio cristallino che all’aumentare della pressione assume svariate forme (I, II, III, …). Precede una discesa agli inferi popolata oltre che da solidi anche da liquidi ultraviscosi. La temperatura TH rappresenta il limite al di sotto del quale l’acqua liquida, anche sottoraffreddata, non può esistere perché subisce una transizione di fase per nucleazione omogenea, divenendo ghiaccio cristallino.
Possiamo rispondere alla domanda: che cosa conferisce all’acqua questo strano comportamento e come si riverbera sui problemi connessi con le nostre consuetudini?
Nella «terra di nessuno» a circa -40 °C è presente un punto critico (C’) che individua il limite di esistenza di due fasi liquide in equilibrio, e che investe anche la zona di esistenza del ghiaccio cristallino. Si tratta di un punto critico virtuale e quindi non individuabile sperimentalmente. La sua influenza si manifesta generando una vasta zona critica che riguarda anche l’acqua ordinaria dove sono presenti ampie fluttuazioni delle sue proprietà.
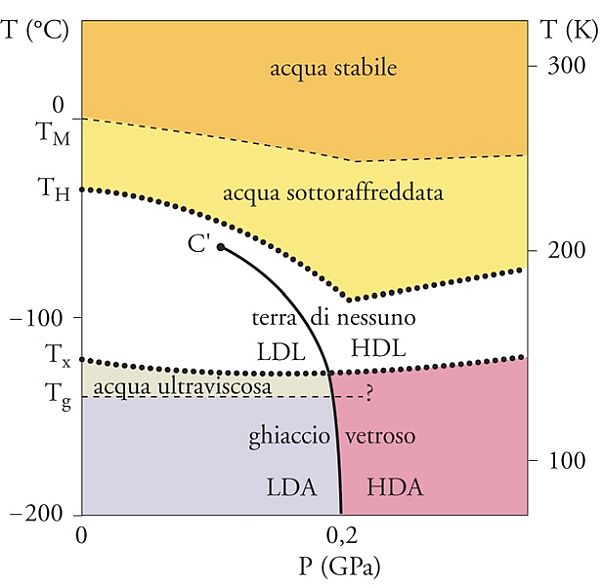
In realtà, la situazione è più complessa se si prende in considerazione l’effetto della pressione perché il ghiaccio vetroso può esistere in almeno due fasi, chiamate rispettivamente LDA (Low density amorphous) e HDA (High density amorphous).
La prima si produce raffreddando con grande rapidità gocce micrometriche di liquido; viceversa, l’HDA si ottiene comprimendo il ghiaccio cristallino al di sotto di 150 K o, in modo alternativo, bombardandolo con un fascio di elettroni. Come si vede nel grafico qui sopra riportato, nella zona a bassa temperatura sono presenti le due fasi condensate vetrose indicate rispettivamente con LDA e HDA. Il passaggio da una all’altra di tali fasi amorfe, o vetrose, è indotto da variazioni di pressione, per cui esiste una linea di confine in corrispondenza della quale ha luogo una transizione di fase associata a una variazione discontinua del volume specifico per unità di massa V.  L’unica zona incerta è quella compresa fra le due curve tratteggiate presenti nella cosiddetta terra di nessuno, nella quale all’aumentare della temperatura si può ipotizzare che siano presenti due ulteriori fasi liquide indicate rispettivamente con LDL (Low Density Liquid) e HDL (High Density Liquid).
L’unica zona incerta è quella compresa fra le due curve tratteggiate presenti nella cosiddetta terra di nessuno, nella quale all’aumentare della temperatura si può ipotizzare che siano presenti due ulteriori fasi liquide indicate rispettivamente con LDL (Low Density Liquid) e HDL (High Density Liquid).
La conoscenza di queste particolari proprietà dell’acqua lascia aperte molte domande anche sulle indagini in corso nell’esplorazione spaziale. Per esempio, quello che è stato chiamato «pianeta Europa» ed è la sesta luna di Giove, poco più piccola della nostra Luna, dotato di una tenue atmosfera di ossigeno, ha una temperatura media di 125 K ed è ricoperto da uno strato esterno di acqua con una crosta superficiale di ghiaccio. Quale acqua? Quale ghiaccio?
L’acqua e il legame a idrogeno
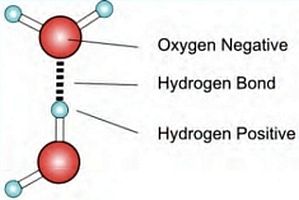 Il «legame a idrogeno» è un legame debole dovuto all’interazione elettrostatica tra l’atomo di idrogeno di una molecola e una coppia solitaria di elettroni presenti nell’atomo di ossigeno di un’altra molecola. I legami a idrogeno sono molto diffusi in natura e svolgono funzioni importantissime nell’ambito biologico, quindi nei fenomeni vitali, perché uniscono le due eliche della molecola di DNA.
Il «legame a idrogeno» è un legame debole dovuto all’interazione elettrostatica tra l’atomo di idrogeno di una molecola e una coppia solitaria di elettroni presenti nell’atomo di ossigeno di un’altra molecola. I legami a idrogeno sono molto diffusi in natura e svolgono funzioni importantissime nell’ambito biologico, quindi nei fenomeni vitali, perché uniscono le due eliche della molecola di DNA.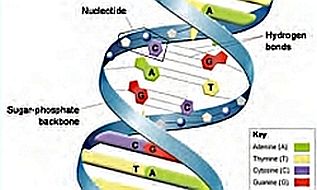 «Cominciai a domandarmi se ogni molecola di DNA non fosse composta da due catene con identiche sequenze di basi tenute insieme da legami a idrogeno» scriveva James Watson nel 1968 ricostruendo il percorso che, con Francis Crick, lo aveva portato a identificare la struttura del DNA. (James Watson, La doppia elica, 1968). D’altra parte, come previsto nel loro famoso articolo pubblicato su Nature nel 1953, la presenza del legame idrogeno «suggeriva» il meccanismo di duplicazione della molecola.
«Cominciai a domandarmi se ogni molecola di DNA non fosse composta da due catene con identiche sequenze di basi tenute insieme da legami a idrogeno» scriveva James Watson nel 1968 ricostruendo il percorso che, con Francis Crick, lo aveva portato a identificare la struttura del DNA. (James Watson, La doppia elica, 1968). D’altra parte, come previsto nel loro famoso articolo pubblicato su Nature nel 1953, la presenza del legame idrogeno «suggeriva» il meccanismo di duplicazione della molecola.
Qual è la struttura della molecola dell’acqua?
Come abbiamo già visto, una molecola isolata di acqua (immagine a sinistra) è costituita da un atomo di ossigeno legato a due atomi di idrogeno, formando un angolo di circa 104°. 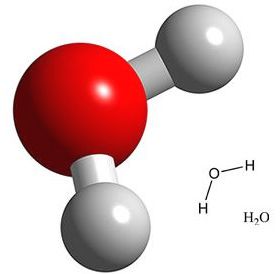 Quando due molecole di acqua si avvicinano (immagine a destra) si stabilisce un legame tra l’atomo di ossigeno di una molecola e l’atomo di idrogeno dell’altra molecola. Si forma così il legame a idrogeno, di natura essenzialmente elettrostatica.
Quando due molecole di acqua si avvicinano (immagine a destra) si stabilisce un legame tra l’atomo di ossigeno di una molecola e l’atomo di idrogeno dell’altra molecola. Si forma così il legame a idrogeno, di natura essenzialmente elettrostatica. 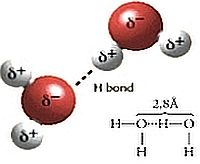 La caratteristica peculiare è la presenza di due coppie solitarie di elettroni che si trovano in corrispondenza di due vertici di un tetraedro (gli altri due vertici sono occupati dagli atomi di idrogeno).
La caratteristica peculiare è la presenza di due coppie solitarie di elettroni che si trovano in corrispondenza di due vertici di un tetraedro (gli altri due vertici sono occupati dagli atomi di idrogeno).
Queste coppie di elettroni conferiscono all’atomo di ossigeno un’elevata elettronegatività, permettendogli di interagire con gli atomi di idrogeno di altre due molecole d’acqua.
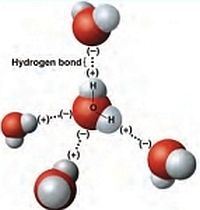 Tali legami idrogeno condizionano in modo radicale la struttura dell’acqua liquida e del ghiaccio poiché le diverse molecole risultano connesse fra di loro. L’energia dei legami idrogeno (circa 5 Kcal/mole), meno di un decimo di quella di un legame covalente, è sufficiente per creare un reticolo di molecole connesse fra di loro nel quale dominano configurazioni tetraedriche che contengono quattro molecole di acqua. La presenza dei legami idrogeno contribuisce ad aumentare i calori di evaporazione e fusione con conseguente aumento delle temperature delle transizioni di fase. Inoltre nel solido si formano configurazioni esagonali aperte che giustificano il valore relativamente basso della densità.
Tali legami idrogeno condizionano in modo radicale la struttura dell’acqua liquida e del ghiaccio poiché le diverse molecole risultano connesse fra di loro. L’energia dei legami idrogeno (circa 5 Kcal/mole), meno di un decimo di quella di un legame covalente, è sufficiente per creare un reticolo di molecole connesse fra di loro nel quale dominano configurazioni tetraedriche che contengono quattro molecole di acqua. La presenza dei legami idrogeno contribuisce ad aumentare i calori di evaporazione e fusione con conseguente aumento delle temperature delle transizioni di fase. Inoltre nel solido si formano configurazioni esagonali aperte che giustificano il valore relativamente basso della densità.
Nel ghiaccio, rappresentato nella parte destra dell’immagine, ogni atomo di ossigeno è legato mediante ponti a idrogeno ad altre 4 molecole.
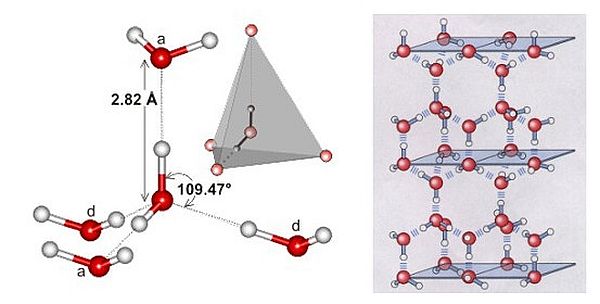
Nell’acqua liquida invece ciascuna molecola si comporta come se avesse due braccia e due centri di attrazione (immagine a fianco), privilegiando la coordinazione tetraedrica fra diverse molecole.  L’acqua liquida è pertanto costituita da un reticolo dinamico soggetto a deformazioni e difetti, con spazi interstiziali occupati da molecole che contribuiscono ad aumentarne la densità rispetto al ghiaccio. Inoltre, la presenza dei legami a idrogeno contribuisce a stabilizzare il sistema, aumentando sensibilmente le entalpie di fusione e di ebollizione e, di conseguenza, le temperature delle corrispondenti transizioni di fase.
L’acqua liquida è pertanto costituita da un reticolo dinamico soggetto a deformazioni e difetti, con spazi interstiziali occupati da molecole che contribuiscono ad aumentarne la densità rispetto al ghiaccio. Inoltre, la presenza dei legami a idrogeno contribuisce a stabilizzare il sistema, aumentando sensibilmente le entalpie di fusione e di ebollizione e, di conseguenza, le temperature delle corrispondenti transizioni di fase.
La connettività fra i diversi legami a idrogeno presenti può essere rappresentata mediante un reticolo bidimensionale. 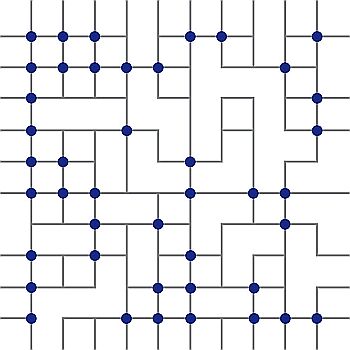 In ciascun vertice viene posta una molecola d’acqua mentre i tratti indicano i legami O-H …O. I punti di incrocio rappresentano gli atomi di ossigeno, mentre i cerchi pieni caratterizzano quelli con quattro legami. Come si nota nell’immagine, sono presenti «grappoli» soggetti a fluttuazioni dinamiche che giustificano la sensitività alle sollecitazioni esterne che si manifesta, per esempio, attraverso gli elevati valori della capacità termica (calore specifico) e della compressibilità isoterma riscontrati sperimentalmente.
In ciascun vertice viene posta una molecola d’acqua mentre i tratti indicano i legami O-H …O. I punti di incrocio rappresentano gli atomi di ossigeno, mentre i cerchi pieni caratterizzano quelli con quattro legami. Come si nota nell’immagine, sono presenti «grappoli» soggetti a fluttuazioni dinamiche che giustificano la sensitività alle sollecitazioni esterne che si manifesta, per esempio, attraverso gli elevati valori della capacità termica (calore specifico) e della compressibilità isoterma riscontrati sperimentalmente.
Un’ulteriore conferma è fornita dal fatto che, se si diluisce l’acqua con una sostanza, quale un alcol, che pur formando legami a idrogeno non può dar luogo a reticoli tetraedrici, i grappoli vengono distrutti e di conseguenza diminuiscono i valori delle funzioni di risposta.
Possiamo chiederci ora: in che modo la connettività degli elementi di un determinato sistema ne influenza il comportamento globale? Si tratta di un problema di ampio respiro poiché si pone anche per le reti neurali, i mercati finanziari, i sistemi sociali.
Per quanto riguarda l’acqua dobbiamo ricordare che al punto critico si manifesta una transizione qualitativa del suo grado di connessione poiché tutto il reticolo può essere attraversato grazie ad un processo che viene si percolazione. Esiste cioè un ordine tetraedrico locale in corrispondenza del quale le molecole presentano una forte tendenza al clustering.
I cluster non sono però iceberg isolati, ma gruppi di molecole fra loro ben legate immerse in una rete a elevata connessione. Questi requisiti possono dare origine a due fasi liquide.
Would-be world: simulare il comportamento dell’acqua
Interessanti ricerche sul comportamento dell’acqua sono state effettuate attraverso simulazioni al computer mediante metodi numerici: un modo speciale per osservare come opera la natura, usando il computer come un microscopio virtuale. 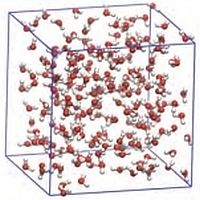 Seguendo un approccio deterministico si può prevedere l’evoluzione di un sistema. In particolare, in base ai principi della dinamica molecolare è possibile simulare il comportamento di una popolazione di molecole sotto l’influenza dei loro potenziali di interazione. Si descrivono le traiettorie delle molecole applicando l’equazione di Newton e le equazioni del moto vengono integrate numericamente per diversi intervalli di tempo.
Seguendo un approccio deterministico si può prevedere l’evoluzione di un sistema. In particolare, in base ai principi della dinamica molecolare è possibile simulare il comportamento di una popolazione di molecole sotto l’influenza dei loro potenziali di interazione. Si descrivono le traiettorie delle molecole applicando l’equazione di Newton e le equazioni del moto vengono integrate numericamente per diversi intervalli di tempo.
Le molecole si muovono sotto l’azione di forze che derivano dalle interazioni reciproche, per cui è molto importante conoscere in modo accurato il potenziale intermolecolare. Per quanto riguarda l’acqua non esiste ancora un accordo generale sulla forma precisa di tale potenziale intermolecolare, perciò il comportamento dell’acqua è difficile da simulare.
Seguendo un approccio stocastico si generano casualmente migliaia di configurazioni che vengono successivamente mediate.  Per l’acqua sono state eseguite con il metodo detto di Monte Carlo molte simulazioni relative alla terra di nessuno. In particolare, si mediano distribuzioni casuali delle molecole generate tenendo conto dei vincoli strutturali ed energetici, investigando la rilevanza di particolari modelli strutturali con siti disposti in una geometria tetraedrica.
Per l’acqua sono state eseguite con il metodo detto di Monte Carlo molte simulazioni relative alla terra di nessuno. In particolare, si mediano distribuzioni casuali delle molecole generate tenendo conto dei vincoli strutturali ed energetici, investigando la rilevanza di particolari modelli strutturali con siti disposti in una geometria tetraedrica.
Le ricerche in queste direzioni hanno il vantaggio di poter confermare la struttura e le caratteristiche dinamiche dell’acqua al di sotto della temperatura TH (vedi immagini nel paragrafo Fatti e previsioni).
In particolare, queste indagini sembrano confermare l’esistenza di una transizione di fase liquido-liquido, con difficoltà di individuazione del punto critico, poiché si tratta di una regione di elevata compressibilità.
Le simulazioni al calcolatore sono state utilizzate anche per confermare che alle basse temperature tendono a costituirsi, localmente, gruppi di molecole aventi due diversi tipi di struttura, LDL e HDL, simili, rispettivamente, a quelle delle due fasi LDA e HDA.
Conoscere l’acqua per usarla bene L’acqua è presente nelle molteplici condizioni e attività della vita e il suo impiego pone alcuni problemi che richiedono una approfondita conoscenza delle sue proprietà chimico fisiche. Ne citiamo di seguito solo alcuni, ma la lista potrebbe essere anche più ampia.
La nucleazione del vapore saturo che interviene nella tecnologie delle macchine termiche e nella meteorologia in relazione alle previsioni sulle precipitazioni atmosferiche.
L’impiego dell’acqua come solvente ha una funzione importante in problemi ambientali e tecnologici.
Il confinamento dell’acqua su nanoscala e il suo flusso attraverso condotti capillari coinvolgenti la geologia, la biologia e particolari tecnologie di interesse biomedico.
L’acqua viene impiegato quale reagente in molte trasformazioni e ha un ruolo particolare su scala molecolare nei sistemi biologici.
Ruolo della nucleazione in meteorologia
Le nubi si formano quando il vapore acqueo contenuto nell’aria (sovra-satura) condensa in goccioline o piccoli cristalli di ghiaccio. Questo processo di trasformazione, schematizzato nell’immagine che segue, è chiamato nucleazione e produce più della metà delle particelle che sono alla base della formazione delle nuvole.
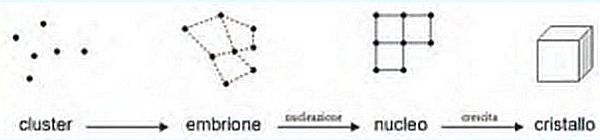
La nucleazione avviene attorno a un «centro di nucleazione», costituito da una particella presente in una soluzione satura o sovrasatura di un particolare componente; nel caso delle nuvole si tratta del vapore acqueo. La particella assume quindi il ruolo di protagonista, dato che è da questa che prende l’avvio tutto il processo.
In realtà quali siano le condizioni per cui una particella diventa un centro di nucleazione non è del tutto chiaro, anche se nell’immagine sono rappresentati, in modo schematico, i diversi meccanismi con cui può avvenire il processo di nucleazione nell’atmosfera.
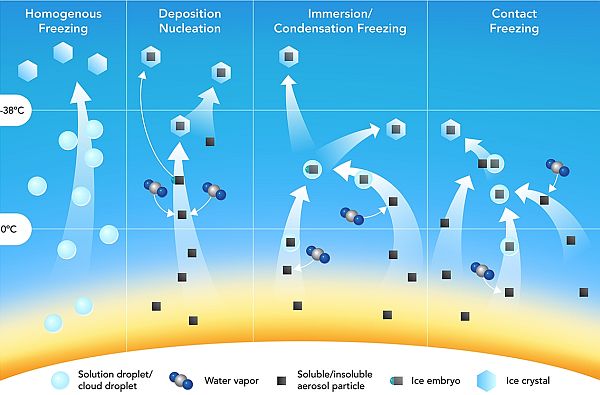
In aria pulita, in assenza di superfici su cui potersi depositare, la formazione di gocce di acqua pura per condensazione del vapore acqueo sovrasaturo avviene per nucleazione detta omogenea (prima colonna) poiché è necessario che molecole d’acqua si uniscano per collisione per arrivare a formare una goccia di dimensioni sufficienti per sopravvivere.
Questo processo non spiega però la formazione delle nubi, poiché per trasformarsi in pioggia, una goccia deve aumentare la sua massa di un milione di volte o più. La nube è generalmente composta sia da gocce che da cristalli di ghiaccio e nel suo interno avvengono processi di evaporazione, condensazione e sublimazione.
Il calcolo della velocità di nucleazione delle gocce d’acqua è particolarmente difficile costituisce l’oggetto di ricerche intese a comprendere la natura del processo ed effettuare delle simulazioni realistiche.
Solubilità della CO2 in acqua
Gli oceani coprono 2/3 della superficie terrestre e giocano pertanto un ruolo vitale nei cicli bio-geochimici globali. Essi assorbono CO2 dall’atmosfera che ne aumenta l’acidità, influendo quindi sui cambiamenti climatici. Le acque oceaniche superficiali sono debolmente basiche con variazioni associate a fattori locali. Nei passati 200 anni hanno assorbito circa la metà della CO2 prodotta dalla attività umane.
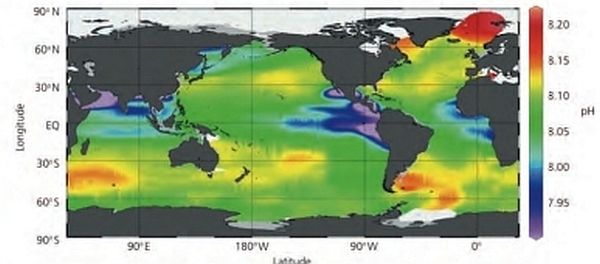
L’anidride carbonica in condizioni ordinarie di temperatura e pressione è un gas supercritico non condensabile. 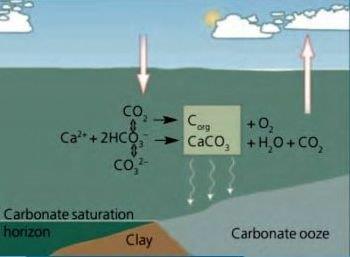 Il suo dissolvimento in acqua è associato alla dissociazione ionica o all’interazione con altre sostanze presenti, in particolare i carbonati. La costante di Henry, che esprime il rapporto fra la concentrazione della CO2 nel gas e quella nel liquido in realtà dipende dalla pressione e presenta incertezze sperimentali.
Il suo dissolvimento in acqua è associato alla dissociazione ionica o all’interazione con altre sostanze presenti, in particolare i carbonati. La costante di Henry, che esprime il rapporto fra la concentrazione della CO2 nel gas e quella nel liquido in realtà dipende dalla pressione e presenta incertezze sperimentali.
I suoi valori sono stati valutati anche mediante simulazioni con il metodo di Monte Carlo ed il confronto con i dati sperimentali risulta soddisfacente (J.Vorlholz et al. Vapour liquid equilibrium of water and carbon dioxide, 1999).
Acqua confinata a nanoscala
Le corrispondenti indagini riguardano problemi concernenti la geologia e la biologia. 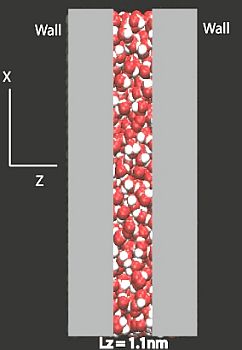 La distribuzione delle molecole d’acqua in una zona confinata può essere determinata mediante simulazioni basate sulla dinamica molecolare (Stanley H.E., Journal of Physics: Condensed matter, 2009).
La distribuzione delle molecole d’acqua in una zona confinata può essere determinata mediante simulazioni basate sulla dinamica molecolare (Stanley H.E., Journal of Physics: Condensed matter, 2009).
L’immagine a lato mostra schematicamente molecole di acqua confinate tra due superfici distanti 1.1 nm. Nei flussi simulati su nanoscala, la dinamica dei liquidi semplici diviene più lenta sotto l’azione della pressione, mentre al contrario per l’acqua la velocità di diffusione aumenta. Ciò è dovuto alla rottura dei legami a idrogeno per cui le molecole d’acqua fluiscono più liberamente.
Il fenomeno è particolarmente significativo per quanto concerne il passaggio dell’acqua attraverso membrane biologiche. Infatti, negli organismi viventi l’acqua è presente in percentuale compresa fra il 45 e il 78 %.
 Affinché possa attraversare una membrana è necessaria la presenza di canali particolari chiamati acquaporine, costituite da una famiglia di proteine che facilitano il flusso molto veloce delle molecole d’acqua all’interno delle cellule di specifici tessuti viventi.
Affinché possa attraversare una membrana è necessaria la presenza di canali particolari chiamati acquaporine, costituite da una famiglia di proteine che facilitano il flusso molto veloce delle molecole d’acqua all’interno delle cellule di specifici tessuti viventi.
Il trasporto è di tipo passivo poiché non richiede una spesa di energia con consumo di ATP, ma è agevolato da gradienti di concentrazione. Immagine 53 carra ok acquaporine 1.jpg
Acqua nei processi biochimici: l’idratazione delle proteine
L’acqua gioca un ruolo essenziale nei processi biochimici agevolando il lavoro delle proteine. Anzitutto per quanto riguarda l’idratazione delle molecole che sono circondate da uno o due strati di acqua la cui presenza è cruciale per il loro funzionamento.  È probabile che le fluttuazione degli strati di acqua influenzi il moto delle proteine stesse (Guo Chen, Paul Fenimore, Los Alamos National Laboratory, 2008).
È probabile che le fluttuazione degli strati di acqua influenzi il moto delle proteine stesse (Guo Chen, Paul Fenimore, Los Alamos National Laboratory, 2008).
Nell’immagine a lato è rappresentata la struttura di una proteina dispersa in acqua e circondata da molecole d’acqua.
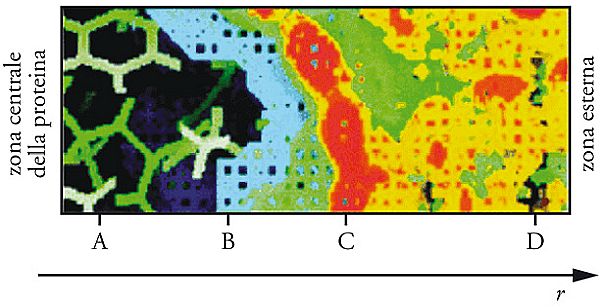
Nell’immagine che segue viene riportata una mappa dell’andamento della densità del solvente nel passaggio dall’interno di una molecola proteica al suo esterno, dove è presente il solo solvente.
I risultati riassunti nella figura, ottenuti mediante simulazione al calcolatore, permettono di distinguere quattro zone: la zona A, nel cuore della proteina, che è libera da solvente; la zona B, nella quale esiste una compenetrazione fra proteina e solvente; la zona C, in corrispondenza della superficie della macromolecola, dove esistono massimi locali di densità del solvente, detti anche zone di idratazione; e infine la zona remota D, nella quale la densità del solvente è uniforme, anche se i processi di diffusione risultano perturbati.
L’acqua superficiale manifesta un comportamento dinamico ed eterogeneo, dovuto sia alle interazioni con i diversi atomi della proteina, sia al disordine topologico e alla rugosità della superficie.
Scambio di acqua nelle proteine 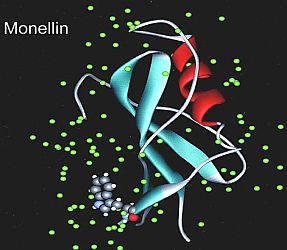 La monellina, una proteina contenente triptofano in superficie, ai raggi X presenta la struttura riportata nell’immagine a destra (H.Zewail, et al. PNAS 2002).
La monellina, una proteina contenente triptofano in superficie, ai raggi X presenta la struttura riportata nell’immagine a destra (H.Zewail, et al. PNAS 2002). 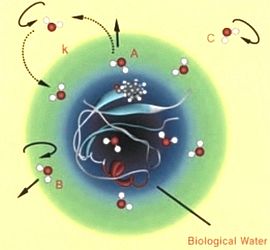 L’immagine a sinistra, che riporta risultati ottenuti mediante dinamica rotazionale su tempi dei femtosecondi, evidenzia schematicamente la presenza, intorno alla monellina, di diversi tipi di molecole d’acqua associate a diversi modi di idratazione: A – molecole legate alla superficie; B,C – molecole quasi libere o libere che contribuiscono alla idratazione attraverso la loro rotazione o traslazione.
L’immagine a sinistra, che riporta risultati ottenuti mediante dinamica rotazionale su tempi dei femtosecondi, evidenzia schematicamente la presenza, intorno alla monellina, di diversi tipi di molecole d’acqua associate a diversi modi di idratazione: A – molecole legate alla superficie; B,C – molecole quasi libere o libere che contribuiscono alla idratazione attraverso la loro rotazione o traslazione.
Scarsità dell’acqua pura nel mondo
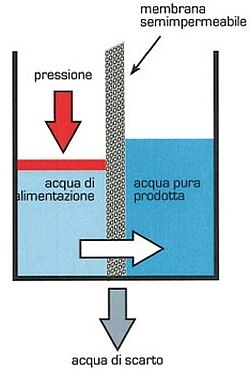 L’approvvigionamento dell’acqua costituisce una sfida impegnativa in tutto il mondo. L’approccio più promettente è basato sulla purificazione dell’acqua marina mediante la tecnica dell’osmosi inversa (schematizzata nell’immagine a lato) nella quale si forza il passaggio del solvente dalla soluzione più concentrata a una più diluita applicando una pressione superiore a quella osmotica.
L’approvvigionamento dell’acqua costituisce una sfida impegnativa in tutto il mondo. L’approccio più promettente è basato sulla purificazione dell’acqua marina mediante la tecnica dell’osmosi inversa (schematizzata nell’immagine a lato) nella quale si forza il passaggio del solvente dalla soluzione più concentrata a una più diluita applicando una pressione superiore a quella osmotica.
Quali problemi presenta tale processo? Si tratta di un processo “energy intensive”, connesso con la disponibilità di energia e quindi con il suo costo. Tenendo conto che l’energia minima richiesta per la desalinizzazione è indipendente dalla tecnologia impiegata.
Come si può diminuire l’energia globale? Uno dei tentativi in atto (oltre a quello di operare a stadi) è quello di migliorare le membrane in modo di diminuire la resistenza al flusso, operando nei seguenti ambiti: la chimica dei polimeri, le nano particelle, i sistemi biologici.
Per esempio, attraverso metodi di polimerizzazione superficiale si producono membrane TFC (Thin Film Composite) che danno ottimi risultati (M.Elimelech, W.Phillip, Science,333, 2011).
Impiego di nanotubi e graphene
Risultati promettenti sono stati ottenuti anche da simulazioni con la Molecular Dynamics utilizzando nanotubi (Ben Corry, J.Phys.Chem. 2008) e grafene idrogenato o ossidrilato.
In particolare, membrane biomimetiche contenenti acquaporine estratte da organismi viventi sono state incorporate entro una matrice di materiale sintetico. L’efficacia del processo è stata confermata calcolando con la simulazione CFD (Fluido Dinamica Computazionale) il flusso dell’acqua nelle acquaporine.
Conclusioni
Le proprietà caratteristiche dell’acqua influenzano profondamente il panorama fisico e il clima del nostro pianeta. Intervengono nei meccanismi e nelle velocità di importanti fenomeni atmosferici quali la formazione dei ghiacci, le piogge e l’elettrificazione. Inoltre sono essenziali per lo svolgimento dei processi chimici e fisici della biologia.
Nell’insieme giustificano l’interesse e le ricerche che vengono condotte a diversi livelli sul comportamento del più abbondante composto liquido presente sulla Terra.
Le sue atipicità si devono comunque ascrivere alla sua struttura molecolare che custodisce misteri e sorprese non ancora chiariti.
Sergio Carrà
(Professore emerito di Chimica Fisica presso il Politecnico di Milano)
(L’articolo riprende i contenuti di una relazione dell’autore al Convegno internazionale “Acqua e Sviluppo”, Milano 14 Gennaio 2015)
© Pubblicato sul n° 61 di Emmeciquadro
