L’articolo presenta in dettaglio un percorso comune realizzato dagli insegnanti di Chimica e di Matematica e Fisica per rispondere a una richiesta spontanea degli studenti della classe quarta di liceo scientifico. Utilizzando il calcolo combinatorio si riconducono all’unità contenuti di Fisica, in particolare il concetto di entropia, e contenuti di Chimica, come la direzione di spontaneità e le condizioni di equilibrio per una trasformazione. Un ciclo di lezioni nuove che ha impegnato gli autori in un lavoro comune per costruire una cerniera tra discipline in generale sviluppate in parallelo senza mai far incontrare agli studenti possibili e interessanti intersezioni. Con un conseguente guadagno dal punto di vista della comprensione e della consapevolezza critica di quanto si sta studiando.
La descrizione e la comprensione dei fenomeni naturali ci permette di indagare la bellezza, l’ordine e la complessità della realtà: in un percorso di studi scientifico si comprende come a questa tensione si riconduce la specializzazione della scienza e la sua articolazione in discipline (Fisica, Chimica, Biologia, Scienze della Terra) e come la domanda conoscitiva sulla realtà si declini ulteriormente al loro interno1. Nel secondo biennio del liceo scientifico, tra le altre, ci si confronta con una importante declinazione: perché osserviamo alcune trasformazioni e non altre? Si affronta perciò il problema della spontaneità, in Chimica per quanto riguarda le reazioni che possono verificarsi e in Fisica per le trasformazioni che non comportano un cambiamento della composizione del sistema. L’introduzione della grandezza entropia rappresenta in questo senso un passo significativo. Nell’esperienza di lavoro con le classi, è emersa una difficoltà da parte degli studenti a ricondurre una variazione di entropia a una variazione di ordine molecolare del sistema: con più facilità riescono a essere interpretati esempi qualitativi, principalmente riferiti a variazioni dello stato fisico di un sistema, mentre permane una difficoltà a concepire una rappresentazione e una misurazione dello stato di ordine molecolare, e come questo può essere modificato da una trasformazione chimica qualsiasi. Nel caso dell’entropia, sembra esserci cioè una difficoltà a mettere in relazione il livello macroscopico con quello microscopico (v. Figura).
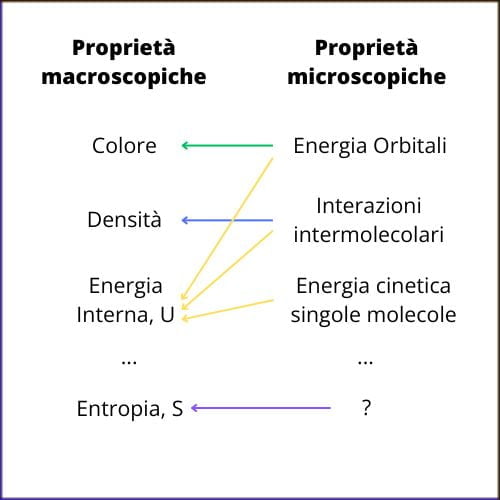
L’occasione della contemporanea disponibilità di strumenti derivanti da diverse discipline (calcolo combinatorio e probabilità in Matematica; termodinamica in Fisica e Chimica; il concetto di quantizzazione nella descrizione dei legami intermolecolari) ha suggerito di approfondire questa relazione attraverso un approccio statistico.
Un problema di numerosità
Se per accedere alle proprietà macroscopiche c’è la possibilità di attuare misurazioni che riguardano tutto il sistema nel suo complesso (cioè di misurare quantità «medie» per il sistema), per le proprietà microscopiche si ha la necessità di studiare una condizione particolare determinata da una precisa combinazione di stati di tutte le molecole che compongono il sistema.
Vai al PDF per l’intero articolo
Roberto Bresciani (docente di Scienze) e Giuditta Formenti (docente di Matematica e Fisica) presso il Liceo Scientifico del Collegio della Guastalla di Monza.
Il percorso descritto in questo articolo è stato presentato e condiviso nel Gruppo di Ricerca «Educare insegnando» di Fisica e Scienze promosso dalla Associazione Il Rischio Educativo, coordinato da Maria Elisa Bergamaschini e Roberto Bresciani: http://www.ilrischioeducativo.org.
